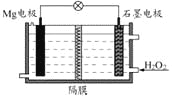
题目内容
【题目】NO、NO2是常见的氧化物。用H2或CO催化还原NO可达到消除污染的目的。
已知:2NO(g)=N2(g)+O2(g) △H= -180.5 kJmol1,2H2O(l)=2H2(g)+O2(g) △H=+571.6 kJmol1。
(1)则用H2催化还原NO消除污染的热化学方程式是_______________。
(2)苯乙烷(C8H10)可生产塑料单体苯乙烯(C8H8),其反应原理是:C8H10 (g)![]() C8H8(g)+H2(g) △H=+120 kJmol1,某温度下,将0.40mol苯乙烷,充入2L真空密闭容器中发生反应,测定不同时间该容器内气体物质的量,得到数据如表:
C8H8(g)+H2(g) △H=+120 kJmol1,某温度下,将0.40mol苯乙烷,充入2L真空密闭容器中发生反应,测定不同时间该容器内气体物质的量,得到数据如表:
时间/min | 0 | 10 | 20 | 30 | 40 |
n(C8H10)/mol | 0.40 | 0.30 | 0.24 | n2 | n3 |
n(C8H8)/mol | 0.00 | 0.10 | n1 | 0.20 | 0.20 |
①当反应进行到20min时,该段时间内H2的平均反应速率是__________。
②该温度下,该反应的化学平衡常数是__________。
③若保持其他条件不变,用0.4molH2(g)和0.4molC8H8(g)合成C8H10(g),当有12kJ热量放出时,该反应中H2的转化率是______.此时,该合成反应是否达到了平衡状态?______(填“是”或“否”)。
【答案】2H2(g)+2NO(g)=N2(g)+2H2O(l)△H=-752.1kJ/mol 0.004mol/(Lmin) 0.1 25% 是
【解析】
(1)根据盖斯定律,由已知热化学方程式乘以适当的系数进行加减得到所需的热化学方程式;
(2)①由化学反应速率公式计算可得;
②建立三段式求解可得;
③依据放出热量计算消耗氢气的量,由转化率公式计算可得;建立三段式求解可得。
(1)将已知反应依次编号为①②,由盖斯定律可知①—②可得H2催化还原NO的热化学方程式2H2(g)+2NO(g)=N2(g)+2H2O(l),则△H=△H1—△H2 =(-180.5 kJ/mol)—(+571.6 kJ/mol)=-752.1kJ/mol,故答案为:2H2(g)+2NO(g)=N2(g)+2H2O(l)△H=-752.1kJ/mol;
(2)①将0.40mol苯乙烷,充入2L真空密闭容器中发生反应,20min后,剩余0.24mol,则反应消耗了(0.40—0.24)mol=0.16mol,则v(C8H10)=![]() =0.004mol/(L·min),由化学反应速率之比等于化学计量数之比可得v(H2)=0.004mol/(L·min),故答案为:0.004mol/(L·min);
=0.004mol/(L·min),由化学反应速率之比等于化学计量数之比可得v(H2)=0.004mol/(L·min),故答案为:0.004mol/(L·min);
②由表格数据可知,30min已达到平衡,由已知数据建立如下三段式:

由三段式数据可得化学平衡常数K=![]() =
=![]() =0.1,故答案为:0.1;
=0.1,故答案为:0.1;
③当有12kJ热量放出时,反应消耗氢气的物质的量为![]() =0.1mol,则反应中H2的转化率为
=0.1mol,则反应中H2的转化率为![]() ×100%=25%;由逆反应的平衡常数是正反应平衡常数的倒数可知合成C8H10的平衡常数为10,由题意建立如下三段式:
×100%=25%;由逆反应的平衡常数是正反应平衡常数的倒数可知合成C8H10的平衡常数为10,由题意建立如下三段式:

由三段式数据可得浓度熵Qc=![]() =
=![]() =10=K,则反应达到平衡,故答案为:25%;是。
=10=K,则反应达到平衡,故答案为:25%;是。