题目内容
13.下表是元素周期表的一部分,按要求填空:| 族 周期 | IA | IIA | IIIA | IVA | VA | VIA | VIIA | 0 |
| 2 | (1) | (2) | ||||||
| 3 | (3) | (4) | (5) | (6) | (7) | (8) | (9) | |
| 4 | (10) | (11) | (12) |
(2)在这些元素中,最活泼的金属元素是K,最活泼的非金属元素是F,最不活泼的元素是Ar.(填元素符号)
(3)最高价氧化物的水化物碱性最强的是KOH(填化学式),电子式:
 ,所含有的化学键为离子键、共价键,熔化时克服作用力为:离子键.
,所含有的化学键为离子键、共价键,熔化时克服作用力为:离子键. (4)在(2)与(8)的单质中,化学性质较活泼的是F2,写出(8)的单质与(3)的最高价氧化物的水化物反应的化学方程式Cl2+2KOH=KCl+KClO+H2O.
(5)在元素(7)(8)中,化学性质较活泼的元素是Cl,请写出从三种角度比较两种元素的活动性的方法:氯气与硫氢化反应置换出硫,高氯酸的酸性比较硫酸的强,氯化氢比硫化氢更稳定.
分析 (1)由元素在周期表中位置,可知(1)为N、(2)为F、(3)为Na、(4)为Mg、(5)为Al、(6)为Si、(7)为S、(8)为Cl、(9)为Ar、(10)为K、(11)为Ca、(12)为Br;
(2)同周期自左而右金属性减弱、非金属性增强,同主族自上而下金属性增强、非金属性减弱;稀有气体的化学性质最不活泼;
(3)上述元素中K的金属性最强,故KOH碱性最强,由钾离子与氢氧根离子构成;
(4)均为非金属元素,非金属性越强,单质越活泼;(3)的最高价氧化物的水化物为KOH,氯气与氢氧化钾反应生成氯化钾、次氯酸钾与水;
(5)均为非金属性元素,非金属性越强,化学性质越活泼;非金属元素强弱判断方法有:非金属单质之间的置换反应、其最高价氧化物的水化物酸性强弱、其气态氢化物的稳定性强弱、其单质与氢气化合难易程度等.
解答 解:(1)由元素在周期表中位置,可知(1)为N、(2)为F、(3)为Na、(4)为Mg、(5)为Al、(6)为Si、(7)为S、(8)为Cl、(9)为Ar、(10)为K、(11)为Ca、(12)为Br,
故答案为:氟;氩;溴;
(2)同周期自左而右金属性减弱、非金属性增强,同主族自上而下金属性增强、非金属性减弱,故上述元素中,最活泼的金属元素是K,最活泼的非金属元素是F;稀有气体Ar的化学性质最不活泼,
故答案为:K;F;Ar;
(3)上述元素中K的金属性最强,故KOH碱性最强,由钾离子与氢氧根离子构成,电子式为 ,所含有的化学键为离子键、共价键,熔化时克服作用力为:离子键,
,所含有的化学键为离子键、共价键,熔化时克服作用力为:离子键,
故答案为:KOH; ;离子键、共价键;离子键;
;离子键、共价键;离子键;
(4)同主族自上而下非金属性减弱,故非金属性F>Cl,化学性质较活泼的是F2,(3)的最高价氧化物的水化物为KOH,氯气与氢氧化钾反应生成氯化钾、次氯酸钾与水,反应方程式为:Cl2+2KOH=KCl+KClO+H2O,
故答案为:F2;Cl2+2KOH=KCl+KClO+H2O;
(5)同周期自左而右非金属性增强,故Cl元素化学性质比S元素活泼,比较两种元素的活动性的方法有:氯气与硫氢化反应置换出硫,高氯酸的酸性比较硫酸的强,氯化氢比硫化氢更稳定,
故答案为:Cl;氯气与硫氢化反应置换出硫,高氯酸的酸性比较硫酸的强,氯化氢比硫化氢更稳定.
点评 本题考查元素周期表与元素周期律,侧重对元素周期律的考查,注意金属性、非金属性强弱比较实验事实,

 高中必刷题系列答案
高中必刷题系列答案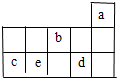 a、b、c、d、e为元素周期表前3周期中的部分元素,它们在元素周期表中的相对位置如图所示.下列叙述正确的是( )
a、b、c、d、e为元素周期表前3周期中的部分元素,它们在元素周期表中的相对位置如图所示.下列叙述正确的是( )| A. | b元素除0价外,只有一种化合价 | |
| B. | 五种元素中,c元素的性质最稳定 | |
| C. | d气态氢化物溶于水,溶液显碱性 | |
| D. | e元素最高价氧化物对应的水化物和不同量的氢氧化钠反应,可能生成三种盐 |
| A. | Cu溶于稀HNO3:3Cu+2NO${\;}_{3}^{-}$+8H+═3Cu2++2NO↑+4H2O | |
| B. | (NH4)2Fe(SO4)2溶液与过量NaOH溶液反应制Fe(OH)2:Fe2++2OH-═Fe(OH)2↓ | |
| C. | 用CH3COOH溶解CaCO3:CaCO3+2H+═Ca2++H2O+CO2↑ | |
| D. | AlCl3溶液中加入过量稀氨水:Al3++4NH3•H2O═AlO${\;}_{2}^{-}$+4NH${\;}_{4}^{+}$+2H2O |
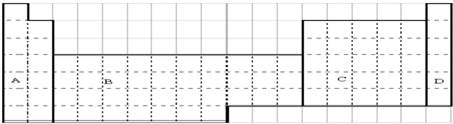
 短周期元素X、Y、Z在周期表中的位置关系如右图所示,据此回答下列问题:
短周期元素X、Y、Z在周期表中的位置关系如右图所示,据此回答下列问题: ;
; .
.