题目内容
12.(1)17g NH3共有10mol电子,同温同压下,等体积的NH3和H2S气体的质量比为1:2,含有的分子数目之比为1:1.(2)在标准状况下,71g Cl2的体积约是22.4L,将其与氢气完全化合生成HCl需氢气的物质的量是1mol.
分析 (1)根据n=$\frac{m}{M}$计算氨气物质的量,电子物质的量为氨气的10倍,同温同压下,等体积的NH3和H2S气体的物质的量相等,根据m=nM计算二者质量之比,二者含有相同分子数目;
(2)根据n=$\frac{m}{M}$计算氯气物质的量,再根据V=nVm计算氯气体积;由H2+Cl2=2HCl可知氯气与氢气的物质的量相等.
解答 解:(1)17g NH3的物质的量为$\frac{17g}{17g/mol}$=1mol,含有电子为1mol×10=10mol电子,同温同压下,等体积的NH3和H2S气体的物质的量相等,根据m=nM可知二者质量之比=17g/mol:34g/mol=1:2,根据N=nNA可知二者含有的分子数目之比为1:1,
故答案为:10;1:2;1:1;
(2)在标准状况下,71g Cl2的物质的量$\frac{71g}{71g/mol}$=1mol,体积约是1mol×22.4L/mol=22.4L,将其与氢气完全化合生成HCl,由H2+Cl2=2HCl可知n(H2)=n(Cl2)=1mol,
故答案为:22.4;1.
点评 本题考查物质的量的有关计算,比较基础,注意对基础知识的理解掌握.

练习册系列答案
 名校课堂系列答案
名校课堂系列答案
相关题目
3.下列反应的离子方程式书写不正确的是( )
| A. | 向Ba(OH)2溶液中逐滴加入NH4HSO4溶液至刚好沉淀完全:Ba2++2OH-+H++SO42-+NH4+═BaSO4↓+NH3•H2O+H2O | |
| B. | Fe(OH)3溶于氢碘酸:Fe(OH)3+3H+═Fe3++3H2O | |
| C. | 硫化钠的水解:S2-+H2O═HS-+OH- | |
| D. | NaHCO3溶液中滴加少量澄清石灰水:2HCO3-+Ca2++2OH-═CaCO3↓+2H2O+CO32- |
20.近年来,科技人员又研究得到一种新型材料--泡沫铝.它是由发泡剂加到熔融或固体粉末的铝合金(合金是指金属跟其他金属或非金属所组成的具有金属特性的物质)中而制成的,其优点是硬度高,密度小(约为0.16~0.5g•cm-3),比木材还轻,可浮于水面,又有很大刚性,且隔音、保温,是一种良好的建筑材料和轻质材料,近几年就可大批量投放市场,则下列关于泡沫铝的说法错误的是( )
| A. | 泡沫铝是纯净物 | |
| B. | 泡沫铝是一种合金 | |
| C. | 泡沫铝是一种优质的建筑材料和轻质材料 | |
| D. | 泡沫铝可用于飞机制造 |
7.下列分离或提纯物质的方法正确的是( )
| A. | 用蒸馏的方法制取海盐 | |
| B. | 用过滤的方法除去Ba(OH)2溶液中含有的少量KOH | |
| C. | 用溶解、过滤、蒸发的方法分离实验室用KClO3制取O2的混合物 | |
| D. | 用加热、蒸发的方法可以除去NaCl固体中混有的CaCl2、MgCl2等杂质 |
4.在托盘天平左右两边分别放上等质量的足量的水和稀H2SO4,指针位于中心,向左烧杯中投入一定量的金属Na(2Na+2H2O═2NaOH+H2↑),右烧杯中投入一定量的金属Mg,充分反应后发现指针仍位于中心,则左盘和右盘转移的电子数之比为( )
| A. | 1:2 | B. | 1:1 | C. | 2:1 | D. | 不能确定 |
13.下表是元素周期表的一部分,按要求填空:
(1)写出下列元素的元素名称(2)氟,(9)氩,(12)溴
(2)在这些元素中,最活泼的金属元素是K,最活泼的非金属元素是F,最不活泼的元素是Ar.(填元素符号)
(3)最高价氧化物的水化物碱性最强的是KOH(填化学式),电子式: ,所含有的化学键为离子键、共价键,熔化时克服作用力为:离子键.
,所含有的化学键为离子键、共价键,熔化时克服作用力为:离子键.
(4)在(2)与(8)的单质中,化学性质较活泼的是F2,写出(8)的单质与(3)的最高价氧化物的水化物反应的化学方程式Cl2+2KOH=KCl+KClO+H2O.
(5)在元素(7)(8)中,化学性质较活泼的元素是Cl,请写出从三种角度比较两种元素的活动性的方法:氯气与硫氢化反应置换出硫,高氯酸的酸性比较硫酸的强,氯化氢比硫化氢更稳定.
| 族 周期 | IA | IIA | IIIA | IVA | VA | VIA | VIIA | 0 |
| 2 | (1) | (2) | ||||||
| 3 | (3) | (4) | (5) | (6) | (7) | (8) | (9) | |
| 4 | (10) | (11) | (12) |
(2)在这些元素中,最活泼的金属元素是K,最活泼的非金属元素是F,最不活泼的元素是Ar.(填元素符号)
(3)最高价氧化物的水化物碱性最强的是KOH(填化学式),电子式:
 ,所含有的化学键为离子键、共价键,熔化时克服作用力为:离子键.
,所含有的化学键为离子键、共价键,熔化时克服作用力为:离子键. (4)在(2)与(8)的单质中,化学性质较活泼的是F2,写出(8)的单质与(3)的最高价氧化物的水化物反应的化学方程式Cl2+2KOH=KCl+KClO+H2O.
(5)在元素(7)(8)中,化学性质较活泼的元素是Cl,请写出从三种角度比较两种元素的活动性的方法:氯气与硫氢化反应置换出硫,高氯酸的酸性比较硫酸的强,氯化氢比硫化氢更稳定.
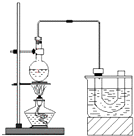 实验室制备溴乙烷(C2H5Br)的装置和步骤如图:
实验室制备溴乙烷(C2H5Br)的装置和步骤如图: