题目内容
2.下列反应的离子方程式正确的是( )| A. | Cu溶于稀HNO3:3Cu+2NO${\;}_{3}^{-}$+8H+═3Cu2++2NO↑+4H2O | |
| B. | (NH4)2Fe(SO4)2溶液与过量NaOH溶液反应制Fe(OH)2:Fe2++2OH-═Fe(OH)2↓ | |
| C. | 用CH3COOH溶解CaCO3:CaCO3+2H+═Ca2++H2O+CO2↑ | |
| D. | AlCl3溶液中加入过量稀氨水:Al3++4NH3•H2O═AlO${\;}_{2}^{-}$+4NH${\;}_{4}^{+}$+2H2O |
分析 A.铜与稀硝酸反应生成硝酸铜、一氧化氮气体和水;
B.氢氧化钠过量,铵根离子与亚铁离子都参与反应;
C.醋酸为弱酸,离子方程式中醋酸不能拆开;
D.一水合氨为弱碱,反应生成氢氧化铝沉淀.
解答 解:A.Cu溶于稀HNO3,反应的离子方程式为:3Cu+2NO3-+8H+═3Cu2++2NO↑+4H2O,故A正确;
B.(NH4)2Fe(SO4)2溶液与过量NaOH溶液反应制Fe(OH)2,铵根离子也参与反应,正确的离子方程式为:2NH4++Fe2++4OH-═Fe(OH)2↓+2NH3•H2O,故B错误;
C.用CH3COOH溶解CaCO3,醋酸与碳酸钙都不能拆开,正确的离子方程式为:CaCO3+2CH3COOH=Ca2++H2O+CO2↑+2CH3COO-,故C错误;
D.AlCl3溶液中加入过量稀氨水,不会弱碱氢氧化铝,正确的离子方程式为:Al3++3NH3•H2O=Al(OH)3↓+3NH4+,故D错误;
故选A.
点评 本题考查了离子方程式的书写判断,为中等难度的试题,注意掌握离子方程式正误判断常用方法:检查反应物、生成物是否正确,检查各物质拆分是否正确,如难溶物、弱电解质等需要保留化学式,检查是否符合原化学方程式等.

练习册系列答案
 名校课堂系列答案
名校课堂系列答案
相关题目
13.下表是元素周期表的一部分,按要求填空:
(1)写出下列元素的元素名称(2)氟,(9)氩,(12)溴
(2)在这些元素中,最活泼的金属元素是K,最活泼的非金属元素是F,最不活泼的元素是Ar.(填元素符号)
(3)最高价氧化物的水化物碱性最强的是KOH(填化学式),电子式: ,所含有的化学键为离子键、共价键,熔化时克服作用力为:离子键.
,所含有的化学键为离子键、共价键,熔化时克服作用力为:离子键.
(4)在(2)与(8)的单质中,化学性质较活泼的是F2,写出(8)的单质与(3)的最高价氧化物的水化物反应的化学方程式Cl2+2KOH=KCl+KClO+H2O.
(5)在元素(7)(8)中,化学性质较活泼的元素是Cl,请写出从三种角度比较两种元素的活动性的方法:氯气与硫氢化反应置换出硫,高氯酸的酸性比较硫酸的强,氯化氢比硫化氢更稳定.
| 族 周期 | IA | IIA | IIIA | IVA | VA | VIA | VIIA | 0 |
| 2 | (1) | (2) | ||||||
| 3 | (3) | (4) | (5) | (6) | (7) | (8) | (9) | |
| 4 | (10) | (11) | (12) |
(2)在这些元素中,最活泼的金属元素是K,最活泼的非金属元素是F,最不活泼的元素是Ar.(填元素符号)
(3)最高价氧化物的水化物碱性最强的是KOH(填化学式),电子式:
 ,所含有的化学键为离子键、共价键,熔化时克服作用力为:离子键.
,所含有的化学键为离子键、共价键,熔化时克服作用力为:离子键. (4)在(2)与(8)的单质中,化学性质较活泼的是F2,写出(8)的单质与(3)的最高价氧化物的水化物反应的化学方程式Cl2+2KOH=KCl+KClO+H2O.
(5)在元素(7)(8)中,化学性质较活泼的元素是Cl,请写出从三种角度比较两种元素的活动性的方法:氯气与硫氢化反应置换出硫,高氯酸的酸性比较硫酸的强,氯化氢比硫化氢更稳定.
7.相对分子质量为M的某物质,在室温下溶解度为$\frac{Sg}{100g}$水,此时测得该物质饱和溶液的密度为ρg/cm3,则该饱和溶液的物质的量的浓度是( )
| A. | $\frac{M}{10s•ρ}$mol/L | B. | $\frac{1000s•ρ}{M(100+s)}$mol/L | ||
| C. | $\frac{10s•ρ}{M}$mol/L | D. | $\frac{M(100+s)}{1000s•ρ}$mol/L |
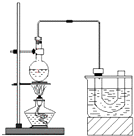 实验室制备溴乙烷(C2H5Br)的装置和步骤如图:
实验室制备溴乙烷(C2H5Br)的装置和步骤如图: ,属于取代反应;
,属于取代反应;