题目内容
【题目】氯及其化合物在生产、生活中都有重要的应用:

(Ⅰ)现实验室要配置一定物质的量浓度的稀盐酸。
(1)如图是某市售盐酸试剂瓶标签上的部分数据。则该盐酸的物质的量浓度是___ mol·L-1。
(2)某同学用该浓盐酸配制100mL 1mol·L-1的稀盐酸。请回答下列问题:
①通过计算可知,需要用量筒量取浓盐酸 ____ mL。
②使用的仪器除量筒、烧杯、玻璃棒外,还必须用到的仪器有_______。
③若配制过程遇下列情况,溶液的物质的量浓度将会:(填“偏高”“偏低”“无影响”)
A.量取的浓盐酸置于烧杯中较长时间后配制______。
B.转移溶液前,洗净的容量瓶内壁附有水珠而未干燥处理___。
C.定容时俯视容量瓶的刻度线_____。
(Ⅱ)实验室使用浓盐酸、二氧化锰共热制氯气,并用氯气和氢氧化钙反应制取少量漂白粉(该反应放热)。已知:MnO2 + 4HCl(浓) ![]() MnCl2 + Cl2↑+ 2H2O;氯气和氢氧化钙在温度较高时会生成副产物氯酸钙。甲、乙、丙三位同学分别设计了三个实验装置如下图所示:
MnCl2 + Cl2↑+ 2H2O;氯气和氢氧化钙在温度较高时会生成副产物氯酸钙。甲、乙、丙三位同学分别设计了三个实验装置如下图所示:
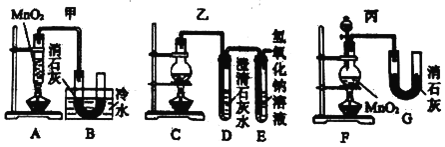
(1)哪位同学的装置能够有效地防止副反应的发生?_____。
(2)上述装置中,甲由A、B两部分组成,乙由C、D、E三部分组成,丙由F、G两部分组成。从上述甲、乙、丙三套装置中选出合理的部分(按气流从左至右的流向)组装一套较完善的实验装置(填所选部分的字母)_____。
(3)利用(2)中实验装置进行实验,实验中若用12 mol·L-1的浓盐酸200 mL与足量二氧化锰反应,最终生成的次氯酸钙的物质的量总小于0.3 mol,其可能的主要原因是_____(假定各步反应均无反应损耗且无副反应发生)。
(Ⅲ)已知HClO的杀菌能力比ClO-强。25℃时将氯气溶于水形成氯气一氯水体系,该体系中Cl2、HClO和ClO-的物质的量分数(a)随pH变化的关系如图所示。
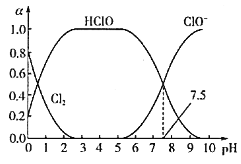
由图分析,欲使氯水的杀菌效果最好,应控制的pH范围是__,当pH=7.5时,氯水中含氯元素的微粒有___。
【答案】11.6 8.6 胶头滴管、100 mL容量瓶 偏低 无影响 偏低 甲 F B E 浓盐酸逐渐变稀,稀盐酸与二氧化锰不反应,且浓盐酸有挥发性,所以盐酸不能全部反应生成氯气,故生成的Ca(ClO)2少于0.3mol 2~6 HClO、ClO-、Cl-
【解析】
(Ⅰ)(1)根据![]() 计算浓度;
计算浓度;
(2)配制一定物质的量浓度的溶液,步骤为计算、量取、稀释、转移、洗涤、定容、摇匀、装瓶;
(Ⅱ)(1)要防止副反应的发生就要控制反应的温度。
(Ⅰ)(1)根据![]() 计算盐酸的浓度,有
计算盐酸的浓度,有![]() ;
;
(2) ①根据溶质的物质的量不变,需要量取的盐酸的体积![]() ;
;
②量取盐酸的时候需要量筒;稀释浓盐酸,需要玻璃棒、烧杯;转移时,需要100mL容量瓶,玻璃棒、烧杯;定容时,需要胶头滴管;则还需要的仪器有100mL容量瓶,胶头滴管;
③A、浓盐酸易挥发,置于烧杯后,较长时间配制,盐酸挥发,溶质减少,溶液的浓度偏低;
B、容量瓶中存在蒸馏水,由于定容前,需要往容量瓶中加入蒸馏水,因此之前存在的蒸馏水,对浓度无影响;
C、俯视刻度线,定容时,水会少加,体积偏小,浓度偏大;
(Ⅱ)(1) 氯气和氢氧化钙在温度较高时会生成副产物氯酸钙,所以必须要控制反应温度,甲装置有冰水浴,可以较好地控制副反应的发生;
(2)F装置可以通过分液漏斗来控制反应的速率,B装置有冰水浴可以较少副反应的发生,E装置可以做到尾气吸收,答案为F B E;
(3)MnO2只与浓盐酸反应生成氯气,虽然反应的进行,浓盐酸浓度降低,不与MnO2反应,所以生成氯气的值小于理论值,答案为浓盐酸逐渐变稀,稀盐酸与二氧化锰不反应,且浓盐酸有挥发性,所以盐酸不能全部反应生成氯气,故生成的Ca(ClO)2少于0.3mol;
(Ⅲ)HClO的杀菌能力比ClO-强,所以HClO的浓度越大,杀菌效果最好,根据图像pH最好为2~6之间;当pH=7.5时,根据图像,氯水中没有Cl2,韩律的微粒有HClO、ClO-以及与水反应生成的Cl-。

 教材全解字词句篇系列答案
教材全解字词句篇系列答案【题目】研究和深度开发CO、CO2的应用对构建生态文明社会具有重要的意义。回答下列问题:
(1)CO可用于高炉炼铁。
已知:Fe3O4(s)+4CO(g)====3Fe(s)+4CO2(g) △H=akJ·mol-1
3Fe2O3(s)+CO(g)====2Fe3O4 (s)+CO2(g) △H=bkJ·mol-1
则反应Fe2O3(s)+3CO(g)====2Fe(s)+3CO2(g)的△H=____________kJ·mol-1(用含a、b的代数式表示)
(2)一定条件下,CO2和CO可以互相转化。某温度下,在容积为2L的密闭容器按甲、乙两种方式投入反应物发生反应:CO2(g)+H2(g)![]() CO(g)+H2O(g)。
CO(g)+H2O(g)。
容器 | 反应物 |
甲 | 8molCO2(g)、16molH2(g) |
乙 | ωmolCO2(g)、xmolH2(g)、ymolCO(g)、zmolH2O(g) |
甲容器15min后达到平衡,此时CO2的转化率为75%。则0~15min内平均反应速率v(H2)= ____________,该温度下反应的平衡常数K=____________。欲使平衡后乙容器与甲容器中相同气体的体积分数分别相等,则ω、x、y、z需满足的关系是y=____________,(用含x、w的代数式表示),且___________。
(3)已知反应C6H5CH2CH3(g)+CO2(g)![]() C6H5CH=CH2(g)+CO(g)+H2O(g) △H。温度、压强对乙苯的平衡转化率的影响如下图所示:
C6H5CH=CH2(g)+CO(g)+H2O(g) △H。温度、压强对乙苯的平衡转化率的影响如下图所示:
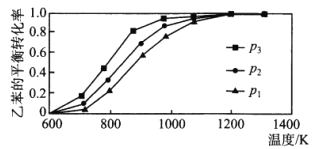
则该反应的△H___________ 0(填“>”“<”或“=”),压强p1、p2、p3从大到小的顺序是___________。
(4)CO可被NO2氧化:CO+NO2![]() CO2+NO。当温度高于225℃时,反应速率v正=k正·c(CO)·c(NO2)、v逆=k逆·c(CO2)·c(NO),k正、k逆分别为正、逆反应速率常数。则k正、k逆与该反应的平衡常数K之间的关系为K=___________。
CO2+NO。当温度高于225℃时,反应速率v正=k正·c(CO)·c(NO2)、v逆=k逆·c(CO2)·c(NO),k正、k逆分别为正、逆反应速率常数。则k正、k逆与该反应的平衡常数K之间的关系为K=___________。