��Ŀ����
����Ŀ��һЩ��ҵ�ķ�ˮ�а����������س��꣬��ˮ�ѵ��ѳ�Ϊ��Ҫ��Ⱦ����ź�ˮ�帻Ӫ�������ε��о��ȵ㣬�ж��ַ�������ȥ����
I�������ҵ��ˮ�����������£�
(1)���ѷ���������ˮ�еİ����������![]() ������̬��
������̬��![]() ����ƽ��״̬�����ڡ�������ֱ��ͨ��ˮ�У�ʹ�����Һ���ֽӴ���ˮ���ܽ�����백������Һ���棬������ת�ƣ��Ӷ��ﵽ�ѳ�����Ŀ�ġ�������ˮ��
����ƽ��״̬�����ڡ�������ֱ��ͨ��ˮ�У�ʹ�����Һ���ֽӴ���ˮ���ܽ�����백������Һ���棬������ת�ƣ��Ӷ��ﵽ�ѳ�����Ŀ�ġ�������ˮ��![]() ��
��![]() ƽ��̬��ƽ���ϵ��________��
ƽ��̬��ƽ���ϵ��________��
(2)�¶ȡ�![]() ֵ�������������ѳ����кܴ��Ӱ�졣
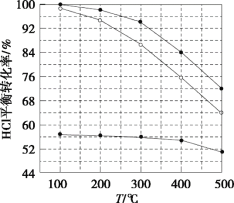
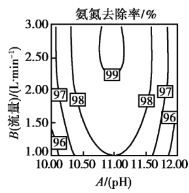
ֵ�������������ѳ����кܴ��Ӱ�졣![]() ֵ�������������ѳ���Ӱ����ͼ��ʾ����ͼ���Կ�������������һ��ʱ��
ֵ�������������ѳ���Ӱ����ͼ��ʾ����ͼ���Կ�������������һ��ʱ��![]() ʱ������������
ʱ������������![]() ���Ӷ����ӣ����û�ѧƽ���ƶ�ԭ������ԭ��________��
���Ӷ����ӣ����û�ѧƽ���ƶ�ԭ������ԭ��________��
(3)�������������������ô�������������ˮ�а��������ӷ���ʽ��________��
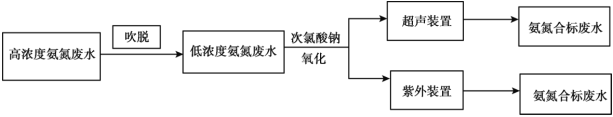
II�����ں���![]() �İ�����ˮ�������õ绯ѧ��������������Эͬȥ��ˮ�еİ�����װ����ͼ��ʾ���������У�ʯīձ�缫����
�İ�����ˮ�������õ绯ѧ��������������Эͬȥ��ˮ�еİ�����װ����ͼ��ʾ���������У�ʯīձ�缫����![]() ����ͨ��
����ͨ��![]() ��������ֲ���
��������ֲ���![]() ��������ˮ�е�
��������ˮ�е�![]() ��ͬʱ
��ͬʱ![]() ������ͨ������
������ͨ������![]() ��������������ȥ��
��������������ȥ��
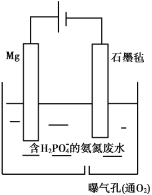
(1)�����ĵ缫��Ӧʽ��________��
(2)��ˮ�е�![]() ת��Ϊ
ת��Ϊ![]() �����ӷ���ʽ��________��
�����ӷ���ʽ��________��
(3)![]() ����
����![]() ������
������![]() �����ɣ�ԭ����________��
�����ɣ�ԭ����________��
���𰸡�![]() NH3+H2O
NH3+H2O![]() +OH-��c(OH-)����������ƽ�������ƶ���
+OH-��c(OH-)����������ƽ�������ƶ���![]() ת��Ϊ����̬��NH3��NH3�ڿ��������´�ˮ���ѳ�
ת��Ϊ����̬��NH3��NH3�ڿ��������´�ˮ���ѳ� ![]()
![]()
![]()
![]() ����
����![]() ʱ��
ʱ��![]() ��
��![]() ����
����![]() �������
�������![]() ��
��![]() �ĵ��뱻���ƣ�ʹ
�ĵ��뱻���ƣ�ʹ![]() ��
��![]() Ũ�Ƚ��ͣ�������
Ũ�Ƚ��ͣ�������![]() ������
������
��������
��(1)NH3����H2O����NH3H2O��NH3H2O���ֵ�������![]() ��OH-��
��OH-��
(2)������Һ������Զ�NH3+H2O![]() +OH-��Ӱ��������
+OH-��Ӱ��������
(3)NaClO����ǿ�����ԣ���������ԭ������![]() ����N2��ͬʱClO-����ԭ����Cl-��
����N2��ͬʱClO-����ԭ����Cl-��
��(1)Mg�ǻ��ý��������ý���������ʱ����������ʧ���ӷ���������Ӧ���ݴ���д�缫��Ӧʽ��
(2) ![]() ��
��![]() ��Mg2+��OH-��H2O��Ӧ����������MgNH4PO46H2O���Ӷ���ȥ��Һ��
��Mg2+��OH-��H2O��Ӧ����������MgNH4PO46H2O���Ӷ���ȥ��Һ��![]() ��
��
(3) ![]() ����
����![]() ʱ����Һ��c(OH-)�ϴ�
ʱ����Һ��c(OH-)�ϴ�![]() ��Mg2+����OH-�������NH3H2O��Mg(OH)2�����(2)��Ӧ����ʽ�������
��Mg2+����OH-�������NH3H2O��Mg(OH)2�����(2)��Ӧ����ʽ�������
��(1)NH3����H2O����NH3H2O��NH3H2O���ֵ�������![]() ��OH-��������Һ�д����ܽ�͵���ƽ�⣬��������ˮ��NH3��
��OH-��������Һ�д����ܽ�͵���ƽ�⣬��������ˮ��NH3��![]() ƽ��̬��ƽ���ϵ��NH3+H2ONH3H2O
ƽ��̬��ƽ���ϵ��NH3+H2ONH3H2O![]() +OH-���ʴ�Ϊ��NH3+H2ONH3H2O
+OH-���ʴ�Ϊ��NH3+H2ONH3H2O![]() +OH-��
+OH-��
(2)NH3+H2O![]() +OH-����Һ��pHֵԽ����Һ��c(OH-)Խ��ƽ��Խ���������ƶ���ʹ
+OH-����Һ��pHֵԽ����Һ��c(OH-)Խ��ƽ��Խ���������ƶ���ʹ![]() ת��Ϊ����̬��NH3��NH3�ڿ��������´�ˮ���ѳ������Կ�������һ��ʱ��10��pH��11ʱ������������pH���Ӷ����ӣ��ʴ�Ϊ��NH3+H2O
ת��Ϊ����̬��NH3��NH3�ڿ��������´�ˮ���ѳ������Կ�������һ��ʱ��10��pH��11ʱ������������pH���Ӷ����ӣ��ʴ�Ϊ��NH3+H2O![]() +OH-��c(OH-)����������ƽ�������ƶ���
+OH-��c(OH-)����������ƽ�������ƶ���![]() ת��Ϊ����̬��NH3��NH3�ڿ��������´�ˮ���ѳ���
ת��Ϊ����̬��NH3��NH3�ڿ��������´�ˮ���ѳ���
(3)NaClO����ǿ�����ԣ���������ԭ������![]() ����N2��ͬʱClO-����ԭ����Cl-�����ӷ���ʽΪ2
����N2��ͬʱClO-����ԭ����Cl-�����ӷ���ʽΪ2![]() +3ClO- +2OH- �TN2+3Cl- +5H2O���ʴ�Ϊ��2
+3ClO- +2OH- �TN2+3Cl- +5H2O���ʴ�Ϊ��2![]() +3ClO- +2OH- �TN2+3Cl- +5H2O��
+3ClO- +2OH- �TN2+3Cl- +5H2O��
��(1)Mg�ǻ��ý��������ý���������ʱ�������Ͻ���ʧ�������ɽ��������ӣ����������ĵ缫��ӦʽΪMg-2e- =Mg2+���ʴ�Ϊ��Mg-2e- =Mg2+��
(2) ![]() ��
��![]() ��Mg2+��OH-��H2O��Ӧ����������MgNH4PO46H2O���Ӷ���ȥ��Һ�е�
��Mg2+��OH-��H2O��Ӧ����������MgNH4PO46H2O���Ӷ���ȥ��Һ�е�![]() ����Ӧ�����ӷ���ʽΪ
����Ӧ�����ӷ���ʽΪ![]() +
+![]() +Mg2++2OH- +4H2O=MgNH4PO46H2O���ʴ�Ϊ��
+Mg2++2OH- +4H2O=MgNH4PO46H2O���ʴ�Ϊ��![]() +
+![]() +Mg2++2OH- +4H2O=MgNH4PO46H2O��
+Mg2++2OH- +4H2O=MgNH4PO46H2O��
(3) ![]() ����
����![]() ʱ����Һ��c(OH-)�ϴ�
ʱ����Һ��c(OH-)�ϴ�![]() ��Mg2+����OH-�������NH3H2O��Mg(OH)2��NH3H2O�ĵ��뱻���ƣ�ʹ
��Mg2+����OH-�������NH3H2O��Mg(OH)2��NH3H2O�ĵ��뱻���ƣ�ʹ![]() ��Mg2+Ũ�Ƚ��ͣ�������MgNH4PO46H2O�����ɣ��ʴ�Ϊ��
��Mg2+Ũ�Ƚ��ͣ�������MgNH4PO46H2O�����ɣ��ʴ�Ϊ��![]() ����
����![]() ʱ��
ʱ��![]() ��Mg2+����OH-�������NH3H2O��Mg(OH)2��NH3H2O�ĵ��뱻���ƣ�ʹ
��Mg2+����OH-�������NH3H2O��Mg(OH)2��NH3H2O�ĵ��뱻���ƣ�ʹ![]() ��Mg2+Ũ�Ƚ��ͣ�������MgNH4PO46H2O�����ɡ�
��Mg2+Ũ�Ƚ��ͣ�������MgNH4PO46H2O�����ɡ�

����Ŀ�������£�ij��ѧС��̽����������Һ�����ʡ�
װ�� | ʵ����� | ʵ����� | ʵ������ |
| ʵ��I | ���Թ��еμ�2%��ˮ�������� | �����غ�ɫ�����������μӳ�����ʧ |
ʵ��II | 1.���Թ��м���0.1mol��L-lNaOH��Һ1mL 2.�����μ�3%H2O2������ | 1.�����غ�ɫ���� 2.����������ɫ��ζ���壬�к�ɫ�������� | |
ʵ��III | 1.���Թ��еμ�1mL0.1molL-1KI��Һ 2.ȡ�����ϲ���Һ���Թܼ��У����������Һ | 1.������ɫ���� 2.��Һ�����Ա仯 |
��֪��AgOH��һ�ְ�ɫ���壬�����¼����ȶ����ֽ�Ϊ�غ�ɫ������ˮ������������
��1�������£�0.1mo1L-1AgNO3��ҺpHԼΪ4���������ӷ���ʽ����ԭ��___��
��2��ʵ��I�У���Ӧ�Ļ�ѧ����ʽ��___��
��3��ʵ��II�У������飬��ɫ�����ijɷ�ΪAg����Ag�����Ļ�ѧ����ʽ��___�����ⶨ��ʵ��������������ԶԶ���ڸ÷�Ӧ������ֵ�����ܵ�ԭ����___��
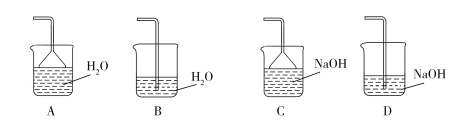
��4��ʵ���У�������ɫ���������ӷ���ʽ��___����ͬѧ���룬I-�л�ԭ�ԣ�Ag+�������ԣ�AgNO3��Һ��KI��ҺӦ�ÿ��Է���������ԭ��Ӧ�����������ͼԭ��أ���ʵ��IV֤���˲�����������У���A�ձ��У�ʯī�缫�����������������ֹ���������Ϊ�����ʡ�����Һ��___������B�ձ��в���IJ�����������___����������ԭ��Ӧ�����ӷ���ʽ��__��

��5���Ա�ʵ��III��ʵ��IV��ʵ��III��I2���ɵĿ���ԭ����___��д����������