题目内容
【题目】氯化氢直接氧化法制氯气的反应是4HCl(g)+O2(g)![]() 2Cl2(g)+2H2O(g)。刚性容器中,进料浓度比c(HCl):c(O2)分别等于1:1、4:1、7:1时,HCl平衡转化率随温度变化的关系如图所示。下列说法不正确的是( )
2Cl2(g)+2H2O(g)。刚性容器中,进料浓度比c(HCl):c(O2)分别等于1:1、4:1、7:1时,HCl平衡转化率随温度变化的关系如图所示。下列说法不正确的是( )
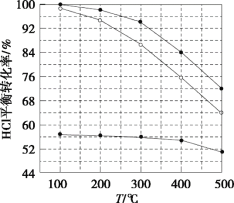
A.K(300℃)>K(400℃)
B.增加反应的压强和及时分离出氯气都可以提高氯化氢的转化率
C.当c(HCl):c(O2)进料比过低时,HCl的转化率较低,且不利于分离O2和Cl2
D.若HCl的初始浓度为c,进料比为1:1时,K(500℃)=![]()
【答案】C
【解析】
A.由图象可知,升高温度,HCl平衡转化率降低,平衡逆向移动,K(300℃)>K(400℃),故A正确;
B.增加反应的压强和及时分离出氯气,平衡正向移动,都可以提高氯化氢的转化率,故B正确;
C.c(HCl):c(O2)进料比越小,HCl的转化率越大,故C错误;
D.相同温度下,c(HCl):c(O2)进料比越大,HCl平衡转化率越小,根据图象,500℃、若HCl的初始浓度为c,进料比为1:1时,HCl平衡转化率为72%,
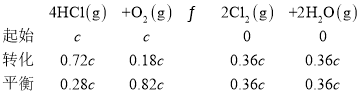
K(500℃)=![]() ,故D正确;
,故D正确;
选C。

 一诺书业暑假作业快乐假期云南美术出版社系列答案
一诺书业暑假作业快乐假期云南美术出版社系列答案【题目】根据下列实验操作和现象所得出的结论正确的是
选项 | 实验操作和现象 | 结论 |
A | 向盛有某盐溶液的试管中滴入氢氧化钠溶液后,加热,试管口处湿润的红色石蕊试纸变蓝 | 该盐中含 |
B | 向溴水中通入某无色气体,溴水褪色 | 该气体可能是CH2=CH2 |
C | 一定量的铜与硝酸充分反应后,有铜剩余,再加入少量稀硫酸,铜继续溶解,并有气泡放出 | Cu与稀硫酸发生了反应 |
D | 向淀粉溶液中加少量稀硫酸,加热4~5min。冷却后向其中加入新制Cu(OH)2悬浊液,加热至沸腾,无砖红色沉淀 | 淀粉没有发生水解 |
A.AB.BC.CD.D
【题目】I.下面列出了几组物质,请用物质的组号填写下表。
类型 | 同位素 | 同素异形体 | 同分异构体 | 同系物 |
组号 | __ | __ | __ | __ |
① ![]() 与
与![]() ②
② ![]() 与
与![]() ③金刚石和石墨 ④12C、13C、14C ⑤
③金刚石和石墨 ④12C、13C、14C ⑤![]() 和
和![]()
II.下图中A、B、C 分别是三种烃的结构模型:

请回答下列问题:
(1)A 的电子式______________,B 的结构简式________________。
(2)A及其同系物的分子式符合通式_____________(用 n 表示)。当 n=____________时,烷烃开始出现同分异构体;当 n=6 时,同分异构体有__________种。
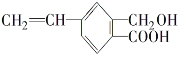
(3)A、B、C 三种有机物中,所有原子均共面的是___________(填名称)。结构简式为 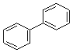 的有机物中,处于同一平面内的原子数最多为__________,处于 同一平面内的碳原子数至少为____________。
的有机物中,处于同一平面内的原子数最多为__________,处于 同一平面内的碳原子数至少为____________。
(4)有机物 C 不具有的结构或性质是_____________(填字母序号)。
a.是碳碳双键和碳碳单键交替的结构 b.有毒、不溶于水、密度比水小
c.不能使酸性 KMnO4 溶液和溴水反应褪色 d.一定条件下能与氢气或氧气反应
(5)等质量的三种有机物完全燃烧生成 H2O 和 CO2,消耗氧气的体积(相同状况下)最大的是_______(填A 或B 或 C)。
III.某有机物的结构简式如图,1mol 该有机物最多可以和______mol氢气反应,最多可以和_____molNaOH 反应。