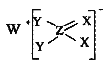题目内容
【题目】(1)写出下列有机物的结构简式
3-甲基己烷______ ,2,3,5-三甲基-4-乙基庚烷______。
(2)某烷烃0.l mol完全燃烧时生成![]() (标况),则其化学式___。其一氯代烷有四种异构体,则该烷烃的名称和结构简式分别是____、____。
(标况),则其化学式___。其一氯代烷有四种异构体,则该烷烃的名称和结构简式分别是____、____。
【答案】![]()
![]()
![]() 2-甲基丁烷
2-甲基丁烷 ![]()
【解析】
由烷烃的名称书写结构简式时,先写主链碳原子,然后按从左到右的顺序给主链碳原子编号,按名称中取代基的位次,在主链碳原子上连接相应的取代基,最后按碳呈四价的原则给碳原子添加氢原子。
(1) 3-甲基己烷的结构简式为![]() 。
。
答案为![]()
2,3,5-三甲基-4-乙基庚烷的结构简式为![]() 。
。
答案为![]()
(2)某烷烃0.l mol完全燃烧时生成![]() (标况),即0.5molCO2,则烷烃分子中所含碳原子为5个,依据烷烃的通式CnH2n+2,可求出氢原子为12个,从而得出该烷烃的化学式为
(标况),即0.5molCO2,则烷烃分子中所含碳原子为5个,依据烷烃的通式CnH2n+2,可求出氢原子为12个,从而得出该烷烃的化学式为![]() 。答案为
。答案为![]()
该烷烃的一氯代烷有四种异构体,则该烷烃的名称为2-甲基丁烷。答案为2-甲基丁烷
和结构简式为![]() 。答案为
。答案为![]()

【题目】某研究小组对碘化钾溶液在空气中发生氧化反应的速率进行实验探究。
(初步探究)
示意图 | 序号 | 温度 | 试剂A | 现象 |
| ① | 0℃ |
|
|
② | 20℃ |
| ||
③ | 20℃ |
|
| |
④ | 20℃ | 蒸馏水 |
|
(1)为探究温度对反应速率的影响,实验②中试剂A应为_________。
(2)写出实验③中![]() 反应的离子方程式:_________________。
反应的离子方程式:_________________。
(3)对比实验②③④,可以得出结论:_________________。
(继续探究)溶液![]() 对反应速率的影响
对反应速率的影响
查阅资料:i.![]() 时,
时,![]() 能被
能被![]() 氧化为I2。
氧化为I2。
ii.![]() 时,
时,![]() 发生歧化反应:
发生歧化反应:![]() ,
,![]() 越大,歧化速率越快。
越大,歧化速率越快。
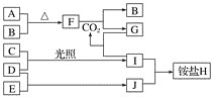
(4)小组同学用4支试管在装有![]() 的储气瓶中进行实验,装置如图所示。
的储气瓶中进行实验,装置如图所示。


分析⑦和⑧中颜色无明显变化的原因:________。
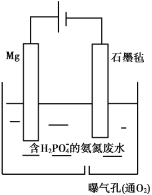
(5)甲同学利用原电池原理设计实验证实![]() 的条件下确实可以发生
的条件下确实可以发生![]() 被
被![]() 氧化为I2的反应,如图所示,请你填写试剂和实验现象____________。
氧化为I2的反应,如图所示,请你填写试剂和实验现象____________。

(深入探究)较高温度对反应速率的影响
小组同学分别在敞口试管和密闭试管中进行了实验⑨和⑩。
序号 | 温度 | 试剂 | 现象 |
⑨敞口试管 | 水浴70°C |
|
|
⑩密闭试管 | 溶液迅速出现黄色,且黄色逐渐加深,冷却至室温后滴加淀粉溶液出现蓝色 |
(6)对比实验⑨和⑩的现象差异,该小组同学经过讨论对实验⑨中的现象提出两种假设,请你补充假设1。
假设1:_____________。
假设2:45℃以上I2易升华,70℃水浴时,![]() 太小难以显现黄色。
太小难以显现黄色。
【题目】Na2SO3是常见的一种盐,工业上可作防腐剂、去氯剂和还原剂。
(1)Na2SO3固体隔绝空气加强热,反应后的固体中含有S2-。反应的化学方程式为________________;若有0.5molNa2SO3参加反应,则电子转移个数为_____________________。
(2)将0.1mol/L Na2SO3溶液先升温再降温,测定温度变化过程中的pH,数据如下:
时刻 | ① | ② | ③ | ④ |
温度/℃ | 25 | 30 | 40 | 25 |
pH | 9.66 | 9.52 | 9.37 | 9.25 |
①时刻Na2SO3溶液中水的电离程度_______同温下纯水中水的电离程度(填)“>”、“<”或“=”);应用平衡原理解释该原因_________________________________。④的pH略小于①,是由于______________________。设计一个简单实验来证明_____________________。
(3)将Na2SO3溶液中所有离子浓度由大到小排列_________________________________。