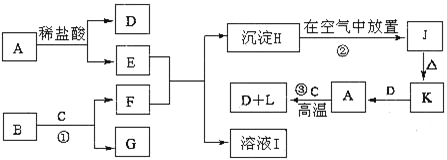
��Ŀ����
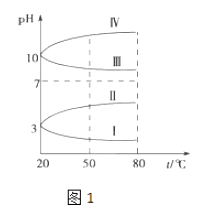
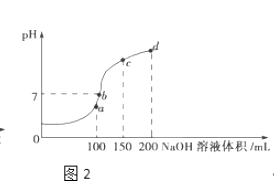
����Ŀ������50mL0.50mol/L������50mLһ��Ũ�ȵ�NaOH��Һ����ͼ��ʾ��װ���н����кͷ�Ӧ�� 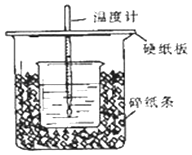
ͨ���ⶨ��Ӧ���������ų��������ɼ����к��ȣ���װ�����������ԵĴ�������һ����ȱ��һ�ֲ��������������������� �� ��һ�������� ��
��ʵ�����ṩ��0.50mol/L��0.55mol/L����Ũ�ȵ�NaOH��Һ��Ӧ��ѡ��molL��1����Һ����ʵ�飮���ձ����粻��Ӳֽ�壬��õ��к�����ֵ���ƫ��ƫС����Ӱ�족����
���������ͬŨ�Ⱥ�����Ĵ��ᣨCH3COOH������HCl��Һ��������ʵ�飬��õ��к��ȵ���ֵ�������ƫ��ƫС����Ӱ�족�� �����60mL0.50mol/L������50mL0.55mol/L��NaOH��Һ�����к��������ȡ�����ȡ�����
���𰸡����β����������С�ձ��ںʹ��ձ���û��ƽ�룻0.55��ƫС��ƫС�����
���������⣺�������ȼƵĹ����֪��װ�õ�ȱ�������ǻ��β�����������к��Ȳⶨʵ��ɰܵĹؼ��DZ��¹����������ձ�Ϊһ���ߣ���������ɢʧ�����Դ��ǣ����β����������С�ձ��ںʹ��ձ���û��ƽ�룻��ʵ�����ṩ��0.50molL��1��0.55molL��1����Ũ�ȵ�NaOH��Һ��Ϊ��ʹ��Ӧ��֣�NaOHӦ����������ѡ��0.55molL��1����Һ����ʵ�飻���ձ����粻��Ӳֽ�壬����һ��������ɢʧ����õ��к�����ֵ�����С�����Դ��ǣ�0.55��ƫС���۴���Ϊ���ᣬ�������Ϊ���ȹ��̣����Դ��ᣨCH3COOH������HCl��Һ��Ӧ����Ӧ�ų�������ƫС���к��ȵ���ֵ��ƫС����Ӧ�ų����������������Լ�������Ķ����йأ������60mL0.50mol/L������50mL0.55mol/L��NaOH��Һ��������ʵ����ȣ�����ˮ�������࣬���ų�������ƫ�ߣ������к��ȵľ���ǿ���ǿ�Ӧ����1molˮʱ�ų����ȣ������������أ��к�����ֵ��ȣ����Դ��ǣ�ƫС����ȣ�

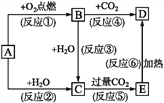
����Ŀ�����������ڹ�ҵ������Ӧ�ù㷺��ij���н����٣�W����WO2��WO3��W2O5�Ļ������Ӹû�����з����WO3��W2O5����ұ�������٣���������ͼ��ʾ��
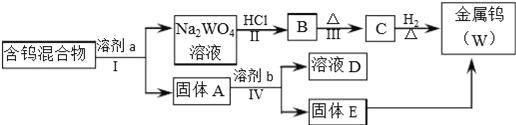
���Ķ����Ͽ�Ƭ���ش��������⣮
�����Ͽ�Ƭ��
i��WO3������NaOH��Na2CO3��Na2C2O4�������ƣ���Һ���γ������Σ�Na2WO4����W2O5�ױ�������Ҳ���ܽ���������Һ�У������ٺ�WO2������������Һ��
ii��WO3�����������ᷴӦ��
iii���ٻ������ڲ�ͬ�ܼ��еĽ�ȡ�ʼ��±�����ȡ�����ܼ��ܽ��������Է����������ּ������Ĺ��̣�����ȡ��Ϊ100%��������еĿ������ȫ���ܽ����ܼ��У���
�ܼ� | ���ʱ�䣨min�� | W2O5��%�� | WO3��%�� | WO2 | ������ |
��100g/L NaOH ��300g/LNa2CO3 ��50g/L Na2CO3 �ܱ���Na2C2O4 �ݱ���Na2C2O4����CO2�����½�ȡ�� | 25 7 30 60 120 | 72.3 76.4 100 4.2 ��0.5 | 100 100 100 100 100 | δ��� | δ��� |
��1�������͢���Ҫ���еIJ�����_______________________________________��
��2�������Ӧ�Ļ�ѧ����ʽ�ֱ���_____________��_____________��
��3��WO3�����ڽ��������Ҳ����____������ԡ��������ԡ����������NaOH��Һ��Ӧ�����ӷ���ʽ��___________________________��
��4��������ǽ�WO3���������ѡ�õ��Լ�a�Ǣݣ�������______��
��5��������ɽ�W2O5���������ѡ�õ��Լ�b��____������E�к��е�������___��D�е�������____��