题目内容
【题目】NH4Al(SO4)2是食品加工中最为快捷的食品添加剂,用于焙烤食品中;NH4HSO4在分析试剂、医药、电子工业中用途广泛,请回答下列问题:
(1)相同条件下,pH相同的NH4Al(SO4)2中c(NH4+)(填“=”、“>”或“<”)NH4HSO4中c(NH4+).
(2)如图1是0.1molL﹣1电解质溶液的pH随温度变化的图象. 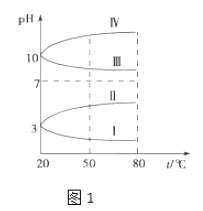
①其中符合0.1molL﹣1NH4Al(SO4)2的pH随温度变化的曲线是(填写字母);
②室温时,0.1molL﹣1NH4Al(SO4)2中2c(SO42﹣)﹣c(NH4+)﹣3c(Al3+)=molL﹣1(填数值)
(3)室温时,向100mL 0.1molL﹣1NH4HSO4溶液中滴加0.1molL﹣1NaOH溶液,得到的溶液pH与NaOH溶液体积的关系曲线如图2所示. 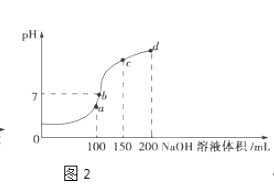
试分析图中a、b、c、d四个点,水的电离程度最大的是;在c点,溶液中各离子浓度由大到小的排列顺序是 .
【答案】
(1)>
(2)Ⅰ;10﹣3
(3)a;c(Na+)>c(SO42﹣)>c(NH4+)>c(OH﹣)>c(H+)
【解析】解:(1)NH4Al(SO4)2与NH4HSO4中的NH4+均发生水解,但是NH4Al(SO4)2中Al3+水解呈酸性抑制NH4+水解,HSO4﹣电离出H+同样抑制NH4+水解,因为HSO4﹣电离生成的H+浓度比Al3+水解生成的H+浓度大,所以NH4HSO4中NH4+水解程度比NH4Al(SO4)2中的小,故答案为:>;(2)①NH4Al(SO4)2水解,溶液呈酸性,升高温度其水解程度增大,pH减小,符合的曲线为Ⅰ,
故答案为:Ⅰ;②根据电荷守恒,可以求出2c(SO42﹣)﹣c(NH4+)﹣3c(Al3+)=c(H+)﹣c(OH﹣)=10﹣3 molL﹣1[c(OH﹣)太小,可忽略],故答案为:10﹣3;(3)a、b、c、d四个点,根据反应量的关系,a点恰好消耗完H+,溶液中只有(NH4)2SO4与Na2SO4;b、c、d三点溶液均含有NH3H2O,(NH4)2SO4可以促进水的电离,而NH3H2O抑制水的电离,c点溶液呈碱性,c(OH﹣)>c(H+),溶液含有(NH4)2SO4、Na2SO4、NH3H2O三种成分,a点时c(Na+)=c(SO42﹣),c点时c(Na+)>c(SO42﹣),根据N元素与S元素的关系,可以得出c(SO42﹣)>c(NH4+),故c(Na+)>c(SO42﹣)>c(NH4+)>c(OH﹣)>c(H+),故答案为:a;c(Na+)>c(SO42﹣)>c(NH4+)>c(OH﹣)>c(H+).
(1)NH4Al(SO4)2中Al3+水解呈酸性抑制NH4+水解,HSO4﹣电离出H+同样抑制NH4+水解;(2)①NH4Al(SO4)2水解,溶液呈酸性,升高温度其水解程度增大;②根据电荷守恒定律解题;(3)a、b、c、d四个点,根据反应量的关系,a点恰好消耗完H+,溶液中只有(NH4)2SO4与Na2SO4;b、c、d三点溶液均含有NH3H2O,(NH4)2SO4可以促进水的电离,而NH3H2O抑制水的电离,c点溶液呈碱性,据此分析.

【题目】向A、B、C和D四支试管中的溶液分别进行表中的操作,通过观察到的实验现象得出的结论正确的是
选项 | 操作 | 现象 | 结论 |
A | ①滴加稀HNO3 ②滴加BaCl2溶液 | 无明显现象 白色沉淀 | 原溶液一定含Ag+ |
B | 滴加稀盐酸 | 有大量气泡产生 | 原溶液一定含CO32﹣ |
C | ①滴加稀HCl ②滴加AgNO3溶液 | 无明显现象 白色沉淀 | 原溶液一定含Cl﹣ |
D | ①加KSCN溶液 ②滴加氯水 | 无明显现象 溶液呈红色 | 原溶液一定含Fe2+ |
A. A B. B C. C D. D