题目内容
【题目】Ⅰ、实验室可以用KMnO4固体和浓盐酸反应制取少量Cl2,反应的化学方程式为:2KMnO4+16HCl(浓)═2KCl+2MnCl2+5Cl2↑+8H2O回答下列问题:
(1)该反应中被氧化的元素是__________.
(2)氧化性:KMnO4__________Cl2(填“>”、“<”或“=”)
(3)该反应中氧化剂和氧化产物的物质的量之比为__________.
(4)用双线桥法表示该反应中电子转移的方向和数目:_________
2KMnO4+16HCl(浓)═2KCl+2MnCl2+5Cl2↑+8H2O
(5)每生成标准状况下2.24L Cl2,反应中转移电子的物质的量为__________.
Ⅱ、实验室常用以下方法制取氯气:MnO2+4HCl(浓)![]() MnCl2+Cl2↑+2H2O请你根据所学知识回答下列问题:
MnCl2+Cl2↑+2H2O请你根据所学知识回答下列问题:
(1)把氯气通入紫色石蕊试液中,可以观察到的现象是:________________,请你解释其中的原因 __________________________________________________
(2)为保证实验安全,常用NaOH溶液吸收多余的氯气。写出反应的化学方程式__________________________________;
【答案】 Cl > 2:5 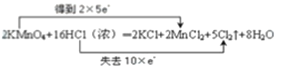 0.2mol 先变红后褪色 氯气和溶液中的水反应生成盐酸和次氯酸,石蕊遇酸变红色;同时次氯酸有漂白性,把变红色的石蕊漂白所以后褪色 Cl2+2NaOH=NaCl+NaClO+H2O
0.2mol 先变红后褪色 氯气和溶液中的水反应生成盐酸和次氯酸,石蕊遇酸变红色;同时次氯酸有漂白性,把变红色的石蕊漂白所以后褪色 Cl2+2NaOH=NaCl+NaClO+H2O
【解析】Ⅰ、(1)HCl中的Cl元素化合价由-1价升高到0价,被氧化,所以被氧化的元素为Cl。
(2)KMnO4是氧化剂,Cl2是氧化产物,氧化剂的氧化性大于氧化产物的氧化性,所以氧化性:KMnO4>Cl2。
(3)KMnO4全部做氧化剂,氧化产物是HCl,所以氧化剂和氧化产物的物质的量之比为2:5。
(4)反应中KMnO4为氧化剂,Mn元素的化合价由+7价降低到+2价,得到5个电子,Cl元素化合价由-1价升高到0价,被氧化,当有2molKMnO4参加反应,转移电子10mol,则电子转移的方向和数目用双线桥法表示如下: 。
。
(5)每生成1molCl2转移2mol电子,标准状况下2.24L Cl2的物质的量为0.1mol,所以转移的电子的物质的量为0.1![]() 2mol=0.2mol。
2mol=0.2mol。
Ⅱ、(1) 氯气与水反应生成HCl和HClO,溶液呈酸性,紫色石蕊试液变红,HClO具有漂白性,把变红色的石蕊漂白。答案为:先变红后褪色、、氯气和溶液中的水反应生成盐酸和次氯酸,石蕊遇酸变红色,同时次氯酸有漂白性,把变红色的石蕊漂白所以后褪色。
(2)氯气有毒,不能随意排放,实验室常常用NaOH溶液吸收,发生的化学方程式为:Cl2+2NaOH=NaCl+NaClO+H2O。

【题目】向A、B、C和D四支试管中的溶液分别进行表中的操作,通过观察到的实验现象得出的结论正确的是
选项 | 操作 | 现象 | 结论 |
A | ①滴加稀HNO3 ②滴加BaCl2溶液 | 无明显现象 白色沉淀 | 原溶液一定含Ag+ |
B | 滴加稀盐酸 | 有大量气泡产生 | 原溶液一定含CO32﹣ |
C | ①滴加稀HCl ②滴加AgNO3溶液 | 无明显现象 白色沉淀 | 原溶液一定含Cl﹣ |
D | ①加KSCN溶液 ②滴加氯水 | 无明显现象 溶液呈红色 | 原溶液一定含Fe2+ |
A. A B. B C. C D. D
【题目】中和滴定是化学定量实验之一.某学生欲用已知物质的量浓度的盐酸来测定未知物质的量浓度的氢氧化钠溶液,请填写下列空白: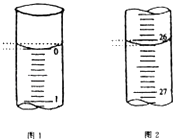
(1)在中和滴定的过程中有如下操作:①用标准溶液润洗滴定管 ②往滴定管内注入标准溶液 ③检查滴定管是否漏水 ④滴定 ⑤洗涤,则在操作过程中正确的顺序是 . (写序号)
(2)选用的指示剂是 . (a、石蕊 b、甲基橙)
(3)用标准的盐酸溶液滴定待测的氢氧化钠溶液时,左手把握酸式滴定管的活塞,右手摇动锥形瓶,眼睛注视 .
(4)下列操作中可能使所测氢氧化钠溶液的浓度数值偏低的是 .
A.酸式滴定管未用标准盐酸溶液润洗就直接注入标准盐酸溶液
B.滴定前盛放氢氧化钠溶液的锥形瓶用蒸馏水洗净后没有干燥
C.酸式滴定管在滴定前有气泡,滴定后气泡消失
D.读取盐酸体积时,开始仰视读数,滴定结束时俯视读数
(5)若滴定开始和结束时,酸式滴定管中的液面如图所示,请将数据填入下面表格的空白处.
滴定次数 | 待测氢氧化钠溶液的体积/mL | 0.1000mol/L 盐酸的体积/mL | ||
滴定前刻度 | 滴定后刻度 | 溶液体积/mL | ||
第一次 | 25.00 | |||
第二次 | 25.00 | 2.00 | 28.08 | 26.08 |
第三次 | 25.00 | 0.22 | 26.34 | 26.12 |
(6)请根据上表中数据列式计算该氢氧化钠溶液的物质的量浓度:c(NaOH)= .
(7)滴定终点的判定依据是 .