题目内容
【题目】亚硝酸钠是重要的防腐剂。某化学兴趣小组以碳和浓硝酸为起始原料,设计如下装置利用一氧化氮与过氧化钠反应制备亚硝酸钠。 (夹持装置和A中加热装置已略,气密性已检验)。
查阅资料:①HNO2为弱酸,室温下存在反应3HNO2==HNO3+2NO↑+H2O;
②在酸性溶液中,NO2-可将MnO4-还原为Mn2+。
③NO不与碱反应,可被酸性KMnO4溶液氧化为硝酸
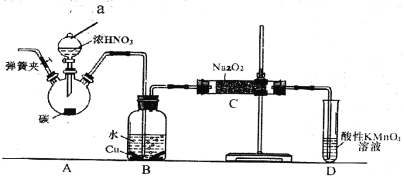
实验操作:①关闭弹簧夹,打开A中分液漏斗活塞,滴加一定量浓硝酸,加热;
②一段时间后停止加热;
③从C中取少量固体,检验是否是亚硝酸钠。
回答下列问题:
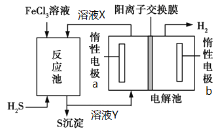
(1)装置中仪器a的名称为___________;D装置的作用是_______________。
(2)A中反应的化学方程式是___________________,C中反应生成NaNO2的化学方程式是____________。
(3)检验C中产物有亚硝酸钠的正确操作是__________
a.取少量生成物溶于水充分振荡,滴加酚酞试液,若溶液变红,则含有NaNO2。
b.取少量生成物溶于稀硫酸,若产生无色气体并在液体上方变为红棕色,则含有NaNO2。
(4)经检验C产物中亚硝酸钠含量较少。
①甲同学认为C中产物不仅有亚硝酸钠,还可能有其它固体物质。为排除干扰,甲在B、C装置间增加装置E,E中盛放的试剂应是________(写名称).
②乙同学认为除上述干扰因素外,还会有空气参与反应导致产品不纯,所以在实验操作①前应增加一步操作,该操作是______________。
(5)NaNO2有毒,国家规定肉制品中NaNO2含量不能超过30mg/kg。从1000g隔夜熟肉, 中提取NaNO3和NaNO2后,配成溶液,再用0.00500mol/L的高锰酸钾(酸性)溶液滴定,消耗高锰酸钾溶液16.00mL,由此计算隔夜熟肉中NaNO2的含量是________mg/kg 。
【答案】
(1)分液漏斗;除去未反应的NO,防止污染空气;
(2)C+4HNO3(浓)![]() CO2↑+4NO2↑+2H2O;2NO+Na2O2=2NaNO2;
CO2↑+4NO2↑+2H2O;2NO+Na2O2=2NaNO2;
(3)b;
(4)①碱石灰;②打开弹簧夹,通入N2一段时间;
(5)13.8。
【解析】
试题分析:(1)根据装置图可知仪器a的名称为分液漏斗,实验中的尾气NO,会污染空气,所以D装置的作用是除去未反应的NO,防止污染空气,故答案为:分液漏斗;除去未反应的NO,防止污染空气;
(2)装置A中是浓硝酸和碳加热发生的反应,反应生成二氧化氮和二氧化碳和水,反应方程式为C+4HNO3(浓)![]() CO2↑+4NO2↑+2H2O,过氧化钠与NO反应会生成NaNO2,反应的化学方程为2NO+Na2O2=2NaNO2,故答案为:C+4HNO3(浓)
CO2↑+4NO2↑+2H2O,过氧化钠与NO反应会生成NaNO2,反应的化学方程为2NO+Na2O2=2NaNO2,故答案为:C+4HNO3(浓)![]() CO2↑+4NO2↑+2H2O;2NO+Na2O2=2NaNO2;
CO2↑+4NO2↑+2H2O;2NO+Na2O2=2NaNO2;
(3)检验亚硝酸钠的实验设计为将生成物置于试管中,加入稀硫酸,若产生无色气体并在液面上方变为红棕色,则D中产物是亚硝酸钠,或将生成物置于试管中,加入酸性KMnO4溶液,若溶液紫色褪去,则D中产物是亚硝酸钠,故选b;
(4)①为排除干扰在B、C装置间增加装置E,E中盛放的试剂应碱石灰,用来吸收二氧化碳;故答案为:碱石灰;
②为避免装置中的空气导致产品不纯,需要打开弹簧夹通入氮气排净装置中的空气,故答案为:打开弹簧夹,通入N2一段时间;
(5)依据电子得失守恒可知,亚硝酸钠与高锰酸钾(酸性)溶液发生氧化还原反应的关系式为5NaNO2~2KMnO4,可计算出1000g隔夜熟肉中NaNO2的质量为2.5×0.00500mol/L×16.00mL×10-3×69=13.8mg,所以隔夜熟肉中NaNO2的含量为13.8mg/kg,故答案为:13.8。