题目内容
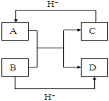
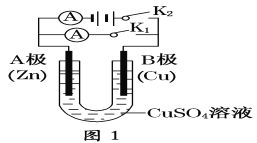
【题目】某同学按如图所示的装置进行试验.A、B为两种常见金属,它们的硫酸盐可溶于水.当K闭合时,在交换膜处SO42﹣从右向左移动.下列分析正确的是( )
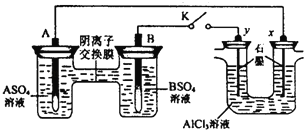
A.溶液中c(A2+)浓度减小
B.B的电极反应:B﹣2e﹣═B2+
C.y电极上有H2产生,发生还原反应
D.反应初期,x电极周围出现白色胶状沉淀,不久沉淀溶解
【答案】D
【解析】
试题分析:左端是原电池,右端是电解池,根据原电池工作原理,阴离子向负极移动,说明A为负极,B为正极,A、A电极反应式A-2e-=A2+,c(A2+)增大,故错误;B、B为正极,发生B2++2e-=B,故错误;C、y极电极电源正极,作阳极,因此是2Cl--2e-=Cl2↑,故错误;D、x接电源负极,作阴极,发生2H2O+2e-=H2↑+2OH-,Al3++3OH-=Al(OH)3↓,随着OH-量增多,沉淀溶解,故正确。

练习册系列答案
相关题目