题目内容
【题目】室温下,用0.1 mol/L HCl溶液滴定10 mL 0.1 mol/L Na2CO3溶液,滴定曲线如图所示。下列说法正确的是
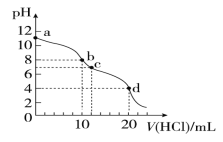
A.a点时:c(Na+)>c(CO32-)>c (HCO3-)>c(OH-)
B.b点时:3c(Na+)=2c(CO32-)+2c(HCO3-)+2c(H2CO3)
C.水电离程度由大到小的顺序为:a>b>c>d
D.d点时:c(H+)>c(HCO3-)=c(CO32-)
【答案】C
【解析】
试题分析:A、Na2CO3溶液的两步水解,以第一步为主,同时存在水的电离故有c(Na+)>c(CO32-)>c(OH-)>c(HCO3-)>c(H2CO3),故A错误;B、此时溶液为等物质的量的NaHCO3和氯化钠的混合物,根据物料守恒,c(Na+)=2c(CO32-)+2c(HCO3-)+2c(H2CO3),故B错误;C、碳酸钠溶液中的氢氧根离子是水电离的,溶液pH越大,水的电离程度越大,则abcd四点水的电离程度大小为:a>b>c,d点盐酸过量,溶液显示酸性,氢离子抑制了水的电离,则d点水的电离程度最小,则水的电离程度大小为:a>b>c>d,故C正确;D、此时溶液为碳酸钠和氯化钠的混合物,碳酸钠的一级水解大于二级水解,c(CO32-) >c(HCO3-),故D错误;故选C。

练习册系列答案
 通城学典默写能手系列答案
通城学典默写能手系列答案
相关题目