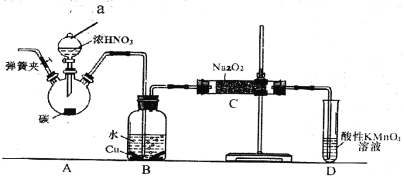
题目内容
【题目】某强酸性溶液X中可能含有Fe2+、Al3+、NH![]() 、CO
、CO![]() 、SO
、SO![]() 、SO
、SO![]() 、Cl-中的若干种,现取X溶液进行连续实验,实验过程及产物如下:
、Cl-中的若干种,现取X溶液进行连续实验,实验过程及产物如下:
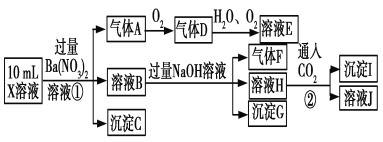
下列说法正确的是
A.气体A是NO2
B.X中肯定存在Fe2+、Al3+、NH![]() 、SO
、SO![]()
C.溶液E和气体F不能发生化学反应
D.X中不能确定的离子是Al3+和Cl-
【答案】D
【解析】
试题分析:强酸性溶液中一定不会存在CO32-和SO32-离子,加入过量硝酸钡生成沉淀,则该沉淀为BaSO4沉淀,说明溶液中含有SO42-离子,生成气体A,A连续氧化生成D和E,则A为NO,D为NO2,E为HNO3,说明溶液中含有还原性离子,一定为Fe2+离子;溶液B中加入过量NaOH溶液,生成气体F,则F为NH3,说明溶液中含有NH4+离子;溶液H中溶于CO2气体,生成沉淀I,则I为Al(OH)3或BaCO3,H为NaAlO2,说明溶液中Al3+离子不能确定,不能确定是否含有的离子是Cl-,A、A是NO,A错误;B、依据分析可知:溶液中一定存在:Fe2+、NH4+、SO42-,B错误;C、溶液E为HNO3,气体F为NH3,二者能反应生成硝酸铵,C错误;C、铝离子可能存在,可能存在氯离子,D正确;答案选D。

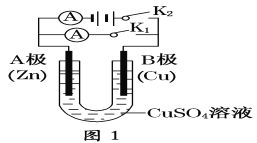
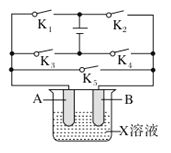
【题目】某课外活动小组准备用如下图所示的装置进行实验。现有甲、乙、丙三位同学分别选择了如下电极材料和电解质溶液:
A电极 | B电极 | X溶液 | |
甲 | Cu | Zn | H2SO4 |
乙 | Pt | Pt | CuCl2 |
丙 | Fe | Cu | ? |
(1)甲同学在实验中将电键K5闭合,Zn电极上的电极反应式为______________。
(2)乙同学准备进行电解CuCl2溶液的实验,则电解时的总反应方程式为___________________。实验时应闭合的电键的组合是________(从下列五项中选择所有可能组合,第(3)小题也在这五项中选择)。
A.K1和K2
B.K1和K3
C.K1和K4
D.K2和K3
E.K2和K4
(3)丙同学准备在Fe上镀Cu,选择了用某种盐来配制电镀液,则该盐中应含的阳离子为________,实验时,应闭合的电键的组合是________。
【题目】利用反应Zn+2FeCl3===ZnCl2+2FeCl2设计一个原电池。
(1)在下图方格内画出实验装置图,
(2)指出正极材料为__________,电极反应式为______________________;
负极材料为____________,电极反应类型为_________________________。
(3)外电路中的电子是从____________极流向__________极。