题目内容
【题目】在探究新制饱和氯水成分的实验中,下列实验现象或结论不正确的是( )
A.氯水的颜色呈浅黄绿色,说明氯水中含有Cl2
B.向氯水中滴加硝酸酸化的AgNO3溶液,产生白色沉淀,说明氯水中含有Cl-
C.向氯水中加入NaHCO3粉末,有气泡产生,说明氯水中含有H+
D.向氯水中滴加紫色石蕊,溶液颜色变成红色,说明氯水中含有HClO
【答案】D
【解析】
氯水中存在平衡Cl2+H2O![]() HCl+HClO,氯气为黄绿色,因此氯水中因含有Cl2而呈浅黄绿色,溶液中含有Cl-,与硝酸银反应生成AgCl白色沉淀;氯水呈酸性,含有H+,能与NaHCO3反应生成CO2;氯水中有HClO存在,因此具有漂白性。
HCl+HClO,氯气为黄绿色,因此氯水中因含有Cl2而呈浅黄绿色,溶液中含有Cl-,与硝酸银反应生成AgCl白色沉淀;氯水呈酸性,含有H+,能与NaHCO3反应生成CO2;氯水中有HClO存在,因此具有漂白性。
A. 氯水中因含有Cl2而呈浅黄绿色,A项正确,不符合题意;
B. 氯水中存在Cl-,与硝酸银反应生成AgCl白色沉淀,B项正确,不符合题意;
C. 氯水呈酸性,含有H+,能与NaHCO3反应生成CO2,C项正确,不符合题意;
D. 向氯水中滴加紫色石蕊,溶液颜色变成红色,说明溶液呈酸性,含有H+,又因氯水中有HClO存在,HClO具有漂白性,最终溶液变为无色,D项错误,符合题意;
答案选D。

 阅读快车系列答案
阅读快车系列答案【题目】已知部分弱酸的电离平衡常数如表:
弱酸 | 醋酸 | 次氯酸 | 碳酸 | 亚硫酸 |
电离平衡常数(25℃) | Ka=1.75×10-5 | Ka=2.98×10-8 | Ka1=4.30×10-7 Ka2=5.61×10-11 | Ka1=1.54×10-2 Ka2=1.02×10-7 |
下列离子方程式正确的是( )
A.少量CO2通入NaClO溶液中:CO2+H2O+2ClO-═CO![]() +2HClO
+2HClO
B.少量SO2通入Ca(ClO)2溶液中:SO2+H2O+Ca2++2ClO-═CaSO3↓+2HClO
C.少量SO2通入Na2CO3溶液中:SO2+H2O+2CO![]() ═SO
═SO![]() +2HCO
+2HCO![]()
D.相同浓度NaHCO3溶液与醋酸溶液等体积混合:H++HCO![]() ═CO2↑+H2O
═CO2↑+H2O
【题目】如图表示的一些物质或概念之间的从属关系不正确的是( )
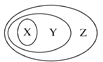
X | Y | Z | |
例 | 氧化物 | 化合物 | 纯净物 |
A | 含氧酸 | 酸 | 化合物 |
B | 溶液 | 分散系 | 混合物 |
C | 强电解质 | 电解质 | 化合物 |
D | 置换反应 | 氧化还原反应 | 离子反应 |
A. A B. B C. C D. D
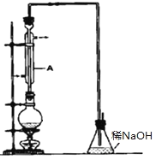
【题目】醇与氢卤酸反应是制备卤代烃的重要方法。实验室制备溴乙烷和1—溴丁烷的反应如下:
NaBr+H2SO4HBr+NaHSO4 ①
R—OH+HBr![]() R—Br+H2O ②
R—Br+H2O ②
可能存在的副反应有:醇在浓硫酸的存在下脱水生成烯和醚,Br—被浓硫酸氧化为Br2等。有关数据列表如下;
乙醇 | 溴乙烷 | 正丁醇 | 1—溴丁烷 | |
密度/g·cm-3 | 0.7893 | 1.4604 | 0.8098 | 1.2758 |
沸点/℃ | 78.5 | 38.4 | 117.2 | 101.6 |
请回答下列问题:
(1)溴乙烷和1—溴丁烷的制备实验中,下列仪器最不可能用到的是________。(填字母)
a.圆底烧瓶 b.量筒 c.锥形瓶 d.长颈漏斗
(2)溴代烃的水溶性______(填“大于”、“等于”或“小于”)相应的醇,将1-溴丁烷粗产品置于分液漏斗中加水,振荡后静置,产物在______(填“上层”、“下层”或“不分层”)
(3)制备操作中,加入的浓硫酸必需进行稀释,其目的是____________。(填字母)
a.减少副产物烯和醚的生成 b.减少Br2的生成
c.减少HBr的挥发 d.水是反应的催化剂
(4)欲除去溴代烷中的少量杂质Br2,下列物质中最适合的是____________。(填字母)
a.NaI b.NaOH c.NaHSO3 d.KCl
(5)在制备溴乙烷时,采用边反应边蒸出产物的方法,其有利于______________ ;
但在制备1—溴丁烷时却不能边反应边蒸出产物,其原因是_______________________。
(6)得到的溴乙烷中含有少量乙醇,为了制得纯净的溴乙烷,可用蒸馏水洗涤,分液后,再加入无水CaCl2后进行的实验操作是______(填字母)
a.分液 b.蒸馏 c.萃取 d.过滤
(7)为了检验溴乙烷中含有溴元素,通常采用的方法是取少量溴乙烷,然后______(按实验的操作顺序选填下列序号)①加热 ②加入AgNO3 ③加入稀HNO3 ④加入NaOH溶液.