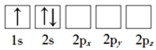
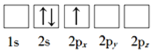
题目内容
【题目】溴乙烷是一种重要的有机化工原料,其沸点为38.4℃。制备溴乙烷的一种方法是乙醇与氢溴酸反应,实际通 常是用溴化钠与一定浓度的硫酸和乙醇反应。某课外小组欲在 实验室制备溴乙烷的装置如图,实验操作步骤如下:
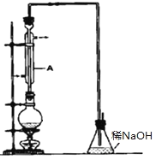
①检查装置的气密性;②在圆底烧瓶中加入 95%乙醇、80% 硫酸,然后加入研细的溴化钠粉末和几粒碎瓷片;③小心加热, 使其充分反应。请回答下列问题。
(1)装置 A 的作用是_____。
(2)反应时若温度过高,则有 SO2 生成,同时观察到还有一种红棕色气体产生,该气体的分子式是_____。
(3)反应结束后,得到的粗产品呈棕黄色。为了除去粗产品中的杂质,可选择下列试剂中 的_________(填写上正确选项的字母)。
a 亚硫酸钠溶液 b 乙醇 c 四氯化碳
该实验操作中所需的主要玻璃仪器是______。(填仪器名称)。
(4)要进一步制得纯净的溴乙烷,可继续用蒸馏水洗涤,分液后,再加入无水 CaCl2,然后进行的实验操作是__________。(填写正确选项的字母)。
a 分液 b 蒸馏 c 萃取
(5)为了检验溴乙烷中含有溴元素,不能直接向溴乙烷中滴加硝酸银溶液来检验,其原因 是_________。通常采用的方法是取少量溴乙烷,然后_____(按 实验的操作顺序选填下列序号)。
①加热 ②加入 AgNO3 溶液 ③加入稀 HNO3 酸化 ④加入 NaOH 溶液
【答案】冷凝回流 Br2 a 分液漏斗 b 溴乙烷不能与硝酸银溶液反应生成沉淀 ④①③②
【解析】
在加热的条件下乙醇和氢溴酸反应生成溴乙烷和水,反应的化学方程式是CH3CH2OH+HBr![]() CH3CH2Br+H2O。
CH3CH2Br+H2O。
(1)实验时,长玻璃导管的作用是冷凝回流,可以获得要制取的有机物,故答案为:冷凝回流;
(2)浓硫酸具有氧化性,可以将还原性的溴离子氧化为溴单质,得到的红棕色气体为溴蒸气,浓硫酸自身被还原为二氧化硫,故答案为:Br2;
(3)溴单质溶解在有机物中显示棕黄色,溴单质具有强氧化性,为了除去粗产品中的杂质溴单质,可以用亚硫酸钠溶液来与之发生反应,且生成的溶液和溴乙烷互不相溶;实现溴乙烷和溶液的分离可以采用分液法,用分液漏斗来分液,故答案为:a;分液漏斗;
(4)用蒸馏水洗涤,分液后,再加入无水CaCl2,溴乙烷的沸点较低,可以采用蒸馏来分离,故答案为:b;
(5)由于溴乙烷不能与硝酸银溶液反应生成沉淀,所以检验溴乙烷中含有溴元素一定要将之转化为溴离子,可以采用卤代烃的水解方法,即加入氢氧化钠,再加热水解,溴离子可以和银离子反应生成淡黄色不溶于硝酸的沉淀溴化银来检验,可以加入硝酸酸化的硝酸银,正确顺序为:④①③②,故答案为:④①③②。