题目内容
【题目】向Ba(OH)2溶液中逐滴加入稀硫酸,请完成下列问题:
(1)写出反应的离子方程式:__。
(2)下列三种情况下,离子方程式与(1)相同的是__(填字母)。
A.向NaHSO4溶液中,逐滴加入Ba(OH)2溶液至溶液显中性
B.向NaHSO4溶液中,逐滴加入Ba(OH)2溶液至![]() 恰好完全沉淀
恰好完全沉淀
C.向NaHSO4溶液中,逐滴加入Ba(OH)2溶液至过量
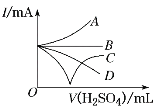
(3)若缓缓加入稀硫酸直至过量,整个过程中混合溶液的导电能力(用电流强度I表示)可近似地用图中的__曲线表示(填字母)。
(4)化合物高铁酸钾K2FeO4可作为一种“绿色高效多功能”的水处理剂,可由FeCl3和KClO在强碱条件下反应制得,该反应的离子方程式为__(反应物写Fe3+)。
【答案】Ba2++2OH-+![]() +2H+=BaSO4↓+2H2O A C 2Fe3++3ClO-+10OH- =2
+2H+=BaSO4↓+2H2O A C 2Fe3++3ClO-+10OH- =2![]() +3Cl-+5H2O
+3Cl-+5H2O
【解析】
书写反应的离子方程式时,遵循“以少定多”的原则,即可假设少量的物质为1mol,则另一物质过量,过量的物质,用量需要多少,就能提供多少。
(1)向Ba(OH)2溶液中逐滴加入稀硫酸,发生反应的化学方程式为Ba(OH)2+ H2SO4= BaSO4↓+ 2H2O,反应的离子方程式:Ba2++2OH-+![]() +2H+=BaSO4↓+2H2O。答案为:Ba2++2OH-+
+2H+=BaSO4↓+2H2O。答案为:Ba2++2OH-+![]() +2H+=BaSO4↓+2H2O;
+2H+=BaSO4↓+2H2O;
(2) A.设NaHSO4为1mol,则n(H+)=1mol,n(![]() )=1mol,逐滴加入Ba(OH)2溶液至溶液显中性,需n(OH-)=1mol,应投入n[Ba(OH)2]=0.5mol,离子方程式为Ba2++2OH-+
)=1mol,逐滴加入Ba(OH)2溶液至溶液显中性,需n(OH-)=1mol,应投入n[Ba(OH)2]=0.5mol,离子方程式为Ba2++2OH-+![]() +2H+=BaSO4↓+2H2O,A符合题意;
+2H+=BaSO4↓+2H2O,A符合题意;
B.设NaHSO4为1mol,则n(H+)=1mol,n(![]() )=1mol,逐滴加入Ba(OH)2溶液至
)=1mol,逐滴加入Ba(OH)2溶液至![]() 恰好完全沉淀,应投入n[Ba(OH)2]=1mol,有1molOH-参加反应,1molOH-剩余,离子方程式为Ba2++OH-+
恰好完全沉淀,应投入n[Ba(OH)2]=1mol,有1molOH-参加反应,1molOH-剩余,离子方程式为Ba2++OH-+![]() +H+=BaSO4↓+H2O,B不合题意;
+H+=BaSO4↓+H2O,B不合题意;
C.设NaHSO4为1mol,则n(H+)=1mol,n(![]() )=1mol,逐滴加入Ba(OH)2溶液至过量,则需消耗n(OH-)=1mol,n(Ba2+)=1mol,离子方程式为Ba2++OH-+
)=1mol,逐滴加入Ba(OH)2溶液至过量,则需消耗n(OH-)=1mol,n(Ba2+)=1mol,离子方程式为Ba2++OH-+![]() +H+=BaSO4↓+H2O,C不合题意;
+H+=BaSO4↓+H2O,C不合题意;
故答案为:A;
(3) 向Ba(OH)2溶液中缓缓加入稀硫酸直至过量,发生反应为Ba2++2OH-+![]() +2H+=BaSO4↓+2H2O,过量的硫酸发生电离H2SO4=2H++
+2H+=BaSO4↓+2H2O,过量的硫酸发生电离H2SO4=2H++![]() 。起初溶液中离子浓度逐渐减小,刚好完全反应时,离子浓度接近0;硫酸过量以后,发生电离,使溶液的导电能力不断增大,最后保持恒定,所以导电能力先减小到接近0,后逐渐增大到一定程度,然后保持不变,故答案为:C;
。起初溶液中离子浓度逐渐减小,刚好完全反应时,离子浓度接近0;硫酸过量以后,发生电离,使溶液的导电能力不断增大,最后保持恒定,所以导电能力先减小到接近0,后逐渐增大到一定程度,然后保持不变,故答案为:C;
(4)FeCl3和KClO在强碱条件下发生氧化还原反应,生成![]() 、Cl-等,根据得失电子守恒、原子守恒和电荷守恒,该反应的离子方程式为2Fe3++3ClO-+10OH- =2
、Cl-等,根据得失电子守恒、原子守恒和电荷守恒,该反应的离子方程式为2Fe3++3ClO-+10OH- =2![]() +3Cl-+5H2O。答案为:2Fe3++3ClO-+10OH- =2
+3Cl-+5H2O。答案为:2Fe3++3ClO-+10OH- =2![]() +3Cl-+5H2O。
+3Cl-+5H2O。