题目内容
【题目】工业上,可采用还原法处理尾气中NO,其原理:2NO(g)+2H2(g)![]() N2(g)+2H2O(g) △H<0。在化学上,正反应速率方程式表示为v(正)=k(正)·cm(NO)·cn(H2),逆反应速率方程式表示为v(逆)=k(逆)·cx(N2)·cy(H2O),其中,k表示反应速率常数,只与温度有关,m,n,x,y叫反应级数,由实验测定。在恒容密闭容器中充入NO、H2,在T℃下进行实验,测得有关数据如下:
N2(g)+2H2O(g) △H<0。在化学上,正反应速率方程式表示为v(正)=k(正)·cm(NO)·cn(H2),逆反应速率方程式表示为v(逆)=k(逆)·cx(N2)·cy(H2O),其中,k表示反应速率常数,只与温度有关,m,n,x,y叫反应级数,由实验测定。在恒容密闭容器中充入NO、H2,在T℃下进行实验,测得有关数据如下:
实验 | c(NO)/mol·L-1 | c(H2)/mol·L-1 | v(正)/mol·L-1·min-1 |
① | 0.10 | 0.10 | 0.414k |
② | 0.10 | 0.40 | 1.656k |
③ | 0.20 | 0.10 | 1.656k |
下列有关推断正确的是
A. 上述反应中,反应物的总能量低于生成物的总能量
B. 若升高温度,则k(正)增大,k(逆)减小
C. 在上述反应中,反应级数:m=2,n=1
D. 在一定温度下,NO、H2的浓度对正反应速率影响程度相同
【答案】C
【解析】
2NO(g)+2H2(g)![]() N2(g)+2H2O(g) △H<0,正反应是放热反应,根据反应热等于正反应活化能与逆反应活化能之差,分析判断A的正误;
N2(g)+2H2O(g) △H<0,正反应是放热反应,根据反应热等于正反应活化能与逆反应活化能之差,分析判断A的正误;
根据升高温度,反应速率加快分析判断B的正误;
根据表格数据知,①、②实验数据比较,可以计算n。①和③比较可以计算m,分析判断C的正误;
根据C的计算结果分析判断D的正误。
A.上述反应的正反应是放热反应,反应热等于正反应活化能与逆反应活化能之差,由此推知,正反应活化能小于逆反应活化能,选项A错误;
B.升高温度,正、逆反应速率都增大,故正、逆反应速率常数都增大,选项B错误;
C.由表格数据知,①、②实验数据比较,![]() =4n=
=4n=![]() =4,故n=1。
=4,故n=1。![]() =2m=
=2m=![]() =4,则m=2,选项C正确;
=4,则m=2,选项C正确;
D.由于正反应速率表达式中NO、H2的反应级数不相等,所以,NO、H2浓度对正反应速率的影响程度不相同,选项D错误;
答案选C。

 七星图书口算速算天天练系列答案
七星图书口算速算天天练系列答案 初中学业考试导与练系列答案
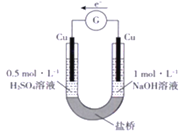
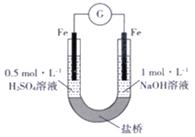
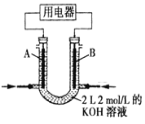
初中学业考试导与练系列答案【题目】研究小组进行如下表所示的原电池实验:
实验编号 | ① | ② |
实验装置 |
|
|
实验现象 | 连接好装置5分钟后,灵敏电流计指针向左偏转,两侧铜片表面均无明显现象 | 连接好装置。开始时左侧铁片表面持续产生气泡,5分钟后,灵敏电流计指针向右偏转,右侧铁片表面无明显现象 |
下列关于该实验的叙述中,正确的是
A. 两装置的盐桥中,阳离子均向右侧移动
B. 实验①中,左侧的铜被腐蚀
C. 实验②中,连接装置5分钟后,左侧电极的电极反应式为:2H++2e-=H2↑
D. 实验①和实验②中,均有O2得电子的反应发生