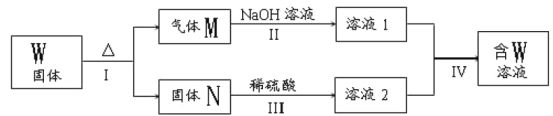
ΧβΡΩΡΎ»ί
ΓΨΧβΡΩΓΩCΓΔNΓΔSΒΡ―θΜ·Έο≥ΘΜα‘λ≥…“Μ–©ΜΖΨ≥Έ ΧβΘ§ΩΤ―–ΙΛΉς’Ώ’ΐ‘Ύ―–ΨΩ”ΟΗς÷÷Μ·―ßΖΫΖ®ά¥œϊ≥ΐ’β–©Έο÷ Ε‘ΜΖΨ≥ΒΡ≤Μάϊ”ΑœλΓΘ
Θ®1Θ©‘Ύ¥ΏΜ·ΦΝ¥φ‘ΎΒΡΧθΦΰœ¬Θ§”ΟH2ΫΪNOΜΙ‘≠ΈΣN2ΓΘ“―÷ΣΘΚ
‘ρ«βΤχΚΆ“Μ―θΜ·ΒΣΖ¥”Π…ζ≥…ΒΣΤχΚΆΥ°’τΤχΒΡ»»Μ·―ßΖΫ≥Χ Ϋ «_____ΓΘ
Θ®2Θ©‘Ύ500Γφœ¬Κœ≥…ΦΉ¥ΦΒΡΖ¥”Π‘≠άμΈΣΘΚ
CO2(g)ΘΪ3H2(g)![]() CH3OH(g)ΘΪH2O(g)‘Ύ1LΒΡΟή±’»ίΤς÷–Θ§≥δ»κ1mol CO2ΚΆ3mol H2Θ§―Ι«ΩΈΣp0Θ§≤βΒΟCO2(g)ΚΆCH3OH(g)ΒΡ≈®Ε»Υφ ±Φδ±δΜ·»γΆΦΥυ ΨΓΘ(Ω…ΡφΖ¥”ΠΒΡΤΫΚβ≥Θ ΐΩ…“‘”ΟΤΫΚβ≈®Ε»ΦΤΥψΘ§“≤Ω…“‘”ΟΤΫΚβΖ÷―ΙKp¥ζΧφΤΫΚβ≈®Ε»Θ§ΦΤΥψΖ÷―ΙΘΫΉή―ΙΓΝΈο÷ ΒΡΝΩΖ÷ ΐ)
CH3OH(g)ΘΪH2O(g)‘Ύ1LΒΡΟή±’»ίΤς÷–Θ§≥δ»κ1mol CO2ΚΆ3mol H2Θ§―Ι«ΩΈΣp0Θ§≤βΒΟCO2(g)ΚΆCH3OH(g)ΒΡ≈®Ε»Υφ ±Φδ±δΜ·»γΆΦΥυ ΨΓΘ(Ω…ΡφΖ¥”ΠΒΡΤΫΚβ≥Θ ΐΩ…“‘”ΟΤΫΚβ≈®Ε»ΦΤΥψΘ§“≤Ω…“‘”ΟΤΫΚβΖ÷―ΙKp¥ζΧφΤΫΚβ≈®Ε»Θ§ΦΤΥψΖ÷―ΙΘΫΉή―ΙΓΝΈο÷ ΒΡΝΩΖ÷ ΐ)
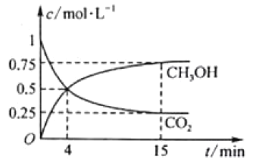
ΔΌΖ¥”ΠΫχ––ΒΫ4min ±Θ§v(’ΐ)__v(Ρφ) (ΧνΓΑ>Γ±ΓΑ<Γ±ΜρΓΑΘΫΓ±)ΓΘ0ΓΪ4minΘ§H2ΒΡΤΫΨυΖ¥”ΠΥΌ¬ v(H2)ΘΫ_molΓΛLΘ≠1ΓΛminΘ≠1ΓΘ
ΔΎCO2ΤΫΚβ ±ΒΡΧεΜΐΖ÷ ΐΈΣ___Θ§ΗΟΈ¬Ε»œ¬KpΈΣ__(”ΟΚ§”–p0ΒΡ ΫΉ”±μ Ψ)ΓΘ
Δέœ¬Ν–ΡήΥΒΟςΗΟΖ¥”Π“―¥οΒΫΤΫΚβΉ¥Χ§ΒΡ «___ΓΘ
A.v’ΐ(CH3OH)ΘΫ3vΡφ(H2)
B.CO2ΓΔH2ΓΔCH3OHΚΆH2O≈®Ε»÷°±»ΈΣ1ΘΚ3ΘΚ1ΘΚ1
C.ΚψΈ¬Κψ―Ιœ¬Θ§ΤχΧεΒΡΧεΜΐ≤Μ‘Ό±δΜ·
D.ΚψΈ¬Κψ»ίœ¬Θ§ΤχΧεΒΡΟήΕ»≤Μ‘Ό±δΜ·
Δή500ΓφΓΔ‘Ύ2Ηω»ίΜΐΕΦ «2LΒΡΟή±’»ίΤς÷–Θ§Α¥≤ΜΆ§ΖΫ ΫΆΕ»κΖ¥”ΠΈοΘ§±Θ≥÷ΚψΈ¬ΓΔΚψ»ίΘ§≤βΒΟΖ¥”Π¥οΒΫΤΫΚβ ±ΒΡ”–ΙΊ ΐΨί»γœ¬ΘΚ
»ίΤς | »ίΤςΦΉ | »ίΤς““ |
Ζ¥”ΠΈοΤπ ΦΆΕ»κΝΩ | 1mol CO2Θ§3mol H2 | 0.5mol CO2Θ§1mol H2 1mol CH3OHΘ§1mol H2O |
CH3OHΒΡΤΫΚβ≈®Ε»/mol ΓΛLΘ≠1 | C1 | C2 |
‘ρ““»ίΤς÷–Ζ¥”ΠΤπ Φœρ___ΖΫœρΫχ––ΘΜc1___c2ΓΘ(ΧνΓΑ>Γ±ΓΑ<Γ±ΜρΓΑΘΫΓ±)
Θ®3Θ©ΦΉ¥ΦΉςΈΣ“Μ÷÷»ΦΝœΜΙΩ…”Ο”Ύ»ΦΝœΒγ≥ΊΓΘ‘ΎΈ¬Ε»ΈΣ650ΓφΒΡ»έ»Ύ―Έ»ΦΝœΒγ≥Ί÷–”ΟΦΉ¥ΦΓΔΩ’Τχ”κCO2ΒΡΜλΚœΤχΧεΉςΖ¥”ΠΈοΘ§ΡχΉςΒγΦΪΘ§”ΟLi2CO3ΚΆNa2CO3ΜλΚœΈοΉςΒγΫβ÷ ΓΘΗΟΒγ≥ΊΒΡΗΚΦΪΖ¥”Π ΫΈΣ___ΓΘ
ΓΨ¥πΑΗΓΩ2NO(g)+2H2 (g)=N2(g)+2H2O(g) ΓςH=Θ≠734.7kJΓΛmol-1 > 0.375 10% 256/(3p02 )Μρ![]() C ΡφΖ¥”Π < CH3OHΘ≠6eΘ≠+3CO32Θ≠=4CO2Γϋ+2H2O
C ΡφΖ¥”Π < CH3OHΘ≠6eΘ≠+3CO32Θ≠=4CO2Γϋ+2H2O
ΓΨΫβΈωΓΩ
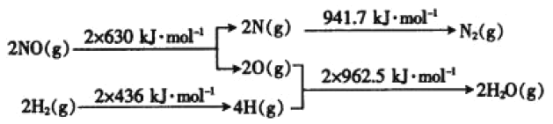
Θ®1Θ©ΓςH=Ζ¥”ΠΈοΉήΦϋΡή-…ζ≥…ΈοΉήΦϋΡήΘΜ
Θ®2Θ©ΔΌΗυΨί4minΚσΘ§Ζ¥”ΠΈοΚΆ…ζ≥…ΈοΝΩΒΡ±δΜ·»ΖΕ®Ζ¥”ΠΖΫœρΘΜΗυΨίv=Γςc/ΓςtΦΤΥψΦΉ¥ΦΜρCO2ΒΡΥΌ¬ Θ§‘ΌΗυΨίΥΌ¬ ±»Β»”ΎΜ·―ßΦΤΝΩ ΐ÷°±»ΦΤΥψ H2ΘΜ
ΔΎΗυΨί»ΐ–– ΫΖ®ΦΤΥψΘΜ
Δέ±δΝΩ≤Μ‘ΎΖΔ…ζΗΡ±δΘ§÷ΛΟςΖ¥”Π¥οΒΫΝΥΤΫΚβΘΜ
ΔήΝ–»ΐ–– ΫΫχ––≈–ΕœΘΜ
Θ®3Θ©»ΦΝœ‘ΎΗΚΦΪΖ¥”ΠΘ§―θΤχ‘Ύ’ΐΦΪΖ¥”ΠΘ§ ι–¥ΒγΦΪΖ¥”Π ΫΓΘ
Θ®1Θ©ΓςH=Ζ¥”ΠΈοΉήΦϋΡή-…ζ≥…ΈοΉήΦϋΡή=2ΓΝ630KJ/mol+2ΓΝ436KJ/mol-941.7 KJ/mol-2ΓΝ962.5KJ/mol=-734.7kJΓΛmol-1‘ρ»»Μ·―ßΖΫ≥Χ ΫΈΣ2NO(g)+2H2 (g)=N2(g)+2H2O(g) ΓςH=Θ≠734.7kJΓΛmol-1ΘΜ
¥πΑΗΘΚ2NO(g)+2H2 (g)=N2(g)+2H2O(g) ΓςH=Θ≠734.7kJΓΛmol-1
Θ®2Θ©ΔΌΖ¥”ΠΫχ––ΒΫ4minΚσΘ§ΦΉ¥ΦΒΡ≈®Ε»»‘‘Ύ‘ωΦ”Θ§Εΰ―θΜ·ΧΦ≈®Ε»»‘‘ΎΦθ–ΓΘ§ΥΒΟςΖ¥”Π‘Ύ’ΐœρΫχ––Θ§‘ρv(’ΐ) >v(Ρφ)ΓΘ0ΓΪ4minΘ§vΘ®CO2Θ©=![]() =0.125 molΓΛLΘ≠1ΓΛminΘ≠1Θ§‘ρH2ΒΡΤΫΨυΖ¥”ΠΥΌ¬ v(H2)=3 vΘ®CO2Θ©ΘΫ3ΓΝ0.125=0.375molΓΛLΘ≠1ΓΛminΘ≠1ΓΘ
=0.125 molΓΛLΘ≠1ΓΛminΘ≠1Θ§‘ρH2ΒΡΤΫΨυΖ¥”ΠΥΌ¬ v(H2)=3 vΘ®CO2Θ©ΘΫ3ΓΝ0.125=0.375molΓΛLΘ≠1ΓΛminΘ≠1ΓΘ
¥πΑΗΘΚ> 0.375
ΔΎ CO2(g)ΘΪ3H2(g)![]() CH3OH(g)ΘΪH2O(g)
CH3OH(g)ΘΪH2O(g)
nΘ®≥θΘ© 1 3 0 0
Γςn 0.75 0.75 0.75 0.75
nΘ®ΤΫΚβΘ©0.25 0.75 0.75 0.75
CO2ΤΫΚβ ±ΒΡΧεΜΐΖ÷ ΐΈΣ![]() =10%ΘΜΤΫΚβΚσΒΡΉή―Ι«ΩΈΣ
=10%ΘΜΤΫΚβΚσΒΡΉή―Ι«ΩΈΣ![]() P0=
P0=![]() Θ§CO2≤ζ…ζΒΡ―Ι«ΩΈΣ
Θ§CO2≤ζ…ζΒΡ―Ι«ΩΈΣ![]() =0.0625P0Θ§«βΤχΓΔΦΉ¥ΦΓΔΥ°’τΤχΤΫΚβΚσΒΡΈο÷ ΒΡΝΩœύΒ»Θ§―Ι«ΩœύΒ»Θ§―Ι«ΩΨυΈΣ
=0.0625P0Θ§«βΤχΓΔΦΉ¥ΦΓΔΥ°’τΤχΤΫΚβΚσΒΡΈο÷ ΒΡΝΩœύΒ»Θ§―Ι«ΩœύΒ»Θ§―Ι«ΩΨυΈΣ![]()
![]() =0.1875P0Θ§ΤΫΚβ≥Θ ΐΈΣKp=
=0.1875P0Θ§ΤΫΚβ≥Θ ΐΈΣKp=![]() =
= ![]() Μρ256/(3p02 )ΘΜ
Μρ256/(3p02 )ΘΜ
¥πΑΗΘΚ10% 256/(3p02 )Μρ![]()
ΔέA.ΥΌ¬ ±»≤ΜΒ»”ΎΜ·―ßΦΤΝΩ ΐ÷°±»Θ§Ι A¥μΈσΘΜ
B.Ζ¥”Π÷–CO2ΓΔH2ΓΔH2O”κCH3OHΒΡΈο÷ ΒΡΝΩ≈®Ε»÷°±»ΨωΕ®”ΎΖ¥”ΠΩΣ Φ ±Φ”»κΈο÷ ΒΡΕύ…ΌΘ§”κΤΫΚβΉ¥Χ§ΈόΙΊΘ§Ι B¥μΈσΘΜ
C.“ρΈΣ’ΐΖ¥”ΠΈΣΤχΧεΧεΜΐΦθ–ΓΒΡΖ¥”ΠΘ§ΚψΈ¬Κψ―Ι ±Θ§Ζ¥”Π’ΐœρΫχ––ΤχΧεΧεΜΐΨΆ‘ΎΦθ–ΓΘ§Β±ΤχΧεΒΡΧεΜΐ≤Μ‘Ό±δΜ·Θ§‘ρ¥οΒΫΤΫΚβΉ¥Χ§Θ§Ι C’ΐ»ΖΘΜ
D.ΗυΨί÷ ΝΩ ΊΚψΕ®¬…Θ§Ζ¥”Π«ΑΚσΤχΧε÷ ΝΩ≤Μ±δΘ§»τΧεΜΐ≤Μ±δΘ§‘ρΟήΕ» Φ÷’≤Μ±δΘ§Υυ“‘ΟήΕ»≤Μ±δ≤ΜΡήΥΒΟςΖ¥”Π¥οΒΫΤΫΚβΉ¥Χ§Θ§Ι D¥μΈσΘΜ
¥πΑΗΘΚC
Δήœ»ΗυΨίΔΎΦΤΥψK
CO2(g)ΘΪ3H2(g)![]() CH3OH(g)ΘΪH2O(g)
CH3OH(g)ΘΪH2O(g)
cΘ®≥θΘ© 1 3 0 0
Γςc 0.75 0.75 0.75 0.75
cΘ®ΤΫΚβΘ© 0.25 0.75 0.75 0.75
k==![]() =
=![]()
»ίΤς““ΘΚ
CO2(g)ΘΪ3H2(g)![]() CH3OH(g)ΘΪH2O(g)
CH3OH(g)ΘΪH2O(g)
cΘ®≥θΘ© 0.25 1/2 0.5 0.5
Qc=![]() =8>k,Ζ¥”ΠΡφΖ¥”ΠΖΫœρΫχ––ΓΘ
=8>k,Ζ¥”ΠΡφΖ¥”ΠΖΫœρΫχ––ΓΘ
»ίΤς““÷–ΤχΧε≥θ ΦΈο÷ ΒΡΝΩ»ΪΜΜΥψΈΣΖ¥”ΠΈο
CO2(g)ΘΪ3H2(g)![]() CH3OH(g)ΘΪH2O(g)
CH3OH(g)ΘΪH2O(g)
nΘ®≥θΘ© 0.5 1 1 1
ΜΜΥψΚσn 1.5 4
»ίΤς““÷–Ζ¥”ΠΈοΒΡ≈®Ε»¥σ”Ύ»ίΤςΦΉΘ§“ρΈΣTΓΔVœύΆ§Θ§‘ρ““»ίΤς÷–Έο÷ ΒΡΤΫΚβ≈®Ε»¥σ”ΎΦΉ»ίΤς÷–Έο÷ ΒΡΤΫΚβ≈®Ε»ΓΘ
¥πΑΗΘΚΡφΖ¥”Π <
Θ®3Θ©ΦΉ¥Φ»ΦΝœΒγ≥Ί÷–ΦΉ¥Φ ßΒγΉ”±Μ―θΜ·Θ§‘ΎΗΚΦΪΖΔ…ζΖ¥”ΠΘ§ΒγΦΪΖ¥”Π ΫΈΣCH3OH+3CO32--6e-=4CO2+2H2OΘΜ
¥πΑΗΘΚ CH3OH+3CO32--6e-=4CO2+2H2O

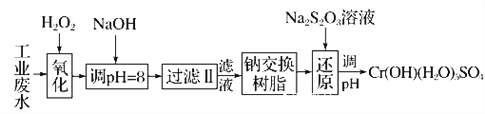
ΓΨΧβΡΩΓΩ÷ΊΫπ τ‘ΣΥΊΗθΒΡΕΨ–‘Ϋœ¥σΘ§Κ§ΗθΖœΥ°–ηΨ≠¥Πάμ¥ο±ξΚσ≤≈Ρή≈≈Ζ≈ΓΘ
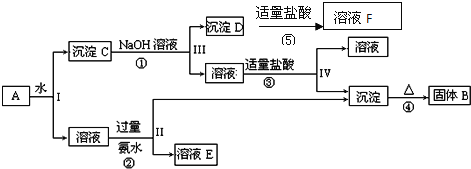
Δώ.Ρ≥ΙΛ“ΒΖœΥ°÷–÷ς“ΣΚ§”–Cr3ΘΪΘ§Ά§ ±ΜΙΚ§”–…ΌΝΩΒΡFe2ΘΪΓΔFe3ΘΪΓΔAl3ΘΪΓΔCa2ΘΪΚΆMg2ΘΪΒ»Θ§«“Υα–‘Ϋœ«ΩΓΘΈΣΜΊ ’άϊ”ΟΘ§Ά®≥Θ≤…”Ο»γœ¬Νς≥Χ¥ΠάμΘΚ
ΉΔΘΚ≥ΘΈ¬œ¬Θ§≤ΩΖ÷―τάκΉ”“‘«β―θΜ·Έο–Έ ΫΆξ»Ϊ≥ΝΒμ ±Υυ–ηΒΡpHΘ§»γœ¬±μΘΚ
«β―θΜ·Έο | Fe(OH)3 | Fe(OH)2 | Mg(OH)2 | Al(OH)3 | Cr(OH)3 |
pH | 3.7 | 9.6 | 11.1 | 8 | 9 |
Θ®1Θ©―θΜ·Ιΐ≥Χ÷–Ω…¥ζΧφH2O2Φ”»κΒΡ ‘ΦΝ «________(ΧνΉ÷ΡΗΘ§œ¬Ά§)ΓΘ
A.Na2O2 B.HNO3 C.FeCl3 D.KMnO4
Θ®2Θ©Φ”»κNaOH»ή“ΚΒς’ϊ»ή“ΚpHΘΫ8 ±Θ§≥ΐ»ΞΒΡάκΉ” «________ΘΜ
“―÷ΣΡΤάκΉ”ΫΜΜΜ ς÷§ΒΡ‘≠άμΘΚMnΘΪΘΪnNaR®DΓζMRnΘΪnNaΘΪΘ§¥Υ≤Ϋ≤ΌΉς±ΜΫΜΜΜ≥ΐ»ΞΒΡ‘”÷ άκΉ” «____________ΓΘ
A.Fe3ΘΪ B.Al3ΘΪ C.Ca2ΘΪ D.Mg2ΘΪ
Θ®3Θ©ΜΙ‘≠Ιΐ≥Χ‘ΎΥα–‘ΧθΦΰœ¬Ϋχ––Θ§ΟΩœϊΚΡ0.8 mol Cr2O![]() ΉΣ“Τ4.8 mol eΘ≠Θ§ΗΟΖ¥”ΠάκΉ”ΖΫ≥Χ ΫΈΣ________________________________________________________________________ΓΘ
ΉΣ“Τ4.8 mol eΘ≠Θ§ΗΟΖ¥”ΠάκΉ”ΖΫ≥Χ ΫΈΣ________________________________________________________________________ΓΘ
Δρ.Υα–‘ΧθΦΰœ¬Θ§ΝυΦέΗθ÷ς“Σ“‘Cr2O![]() –Έ Ϋ¥φ‘ΎΘ§ΙΛ“Β…œ≥Θ”ΟΒγΫβΖ®¥ΠάμΚ§Cr2O
–Έ Ϋ¥φ‘ΎΘ§ΙΛ“Β…œ≥Θ”ΟΒγΫβΖ®¥ΠάμΚ§Cr2O![]() ΒΡΖœΥ°Θ§ΗΟΖ®”ΟFeΉςΒγΦΪΒγΫβΚ§Cr2O
ΒΡΖœΥ°Θ§ΗΟΖ®”ΟFeΉςΒγΦΪΒγΫβΚ§Cr2O![]() ΒΡΥα–‘ΖœΥ°Θ§ΥφΉ≈ΒγΫβΫχ––Θ§‘Ύ“θΦΪΗΫΫϋ»ή“ΚpH…ΐΗΏΘ§≤ζ…ζCr(OH)3»ή“ΚΓΘ
ΒΡΥα–‘ΖœΥ°Θ§ΥφΉ≈ΒγΫβΫχ––Θ§‘Ύ“θΦΪΗΫΫϋ»ή“ΚpH…ΐΗΏΘ§≤ζ…ζCr(OH)3»ή“ΚΓΘ
Θ®1Θ©ΒγΫβ ±ΡήΖώ”ΟCuΒγΦΪά¥¥ζΧφFeΒγΦΪΘΩ________(ΧνΓΑΡήΓ±ΜρΓΑ≤ΜΡήΓ±)Θ§άμ”… «_____________ΓΘ
Θ®2Θ©≥ΘΈ¬œ¬Θ§Cr(OH)3ΒΡ»ήΕ»ΜΐKspΘΫ1ΓΝ10Θ≠20Θ§ΦΌ…η»ή“ΚΒΡc(Cr3ΘΪ)=0.01mol/LΘ§Β±pH”ΠΈΣ______ ±ΩΣ Φ…ζ≥…≥ΝΒμΓΘ
ΓΨΧβΡΩΓΩάϊ”ΟΆΦ ΨΉΑ÷ΟΫχ–– Β―ιΘ§Ζ¥”ΠΫχ––ΉψΙΜ≥Λ ±ΦδΚσΉΑ÷ΟII÷– Β―ιœ÷œσ’ΐ»ΖΒΡ «
ΔΌ | ΔΎ | Δέ | II÷– Β―ιœ÷œσ |
| |
A | ≈®―ΈΥα | ΧΦΥαΗΤ | ΒΈ”–Ζ”ΧΣΒΡœΓΧΦΥαΡΤ»ή“Κ | »ή“Κ”…Κλ…Ϊ±δΈΣ«≥Κλ…Ϊ | |
B | ≈®Α±Υ° | ―θΜ·ΗΤ | ΝρΥα―«Χζ»ή“Κ | ≤ζ…ζ¥σΝΩΑΉ…Ϊ≥ΝΒμ | |
C | ±υ¥ΉΥα | ““¥ΦΚΆ≈®ΝρΥα | ±ΞΚΆΧΦΥαΡΤ»ή“Κ | »ή“ΚΖ÷≤ψΘ§…œ≤ψΈΣ”ΆΉ¥“ΚΧε | |
D | NH4Cl»ή“Κ | NaAlO2»ή“Κ | Ήœ…Ϊ ·»ο ‘“Κ | »ή“Κ”…Ήœ…Ϊ±δΈΣάΕ…Ϊ |
A. AB. BC. CD. D
ΓΨΧβΡΩΓΩ Β―ι “”ΟΟήΕ»ΈΣ1.25 gmL©¹1ΓΔ÷ ΝΩΖ÷ ΐΈΣ36.5%ΒΡ≈®―ΈΥα≈δ÷Τ240 mL 0.1 molL©¹1ΒΡ―ΈΥαΘ§«κΜΊ¥πœ¬Ν–Έ ΧβΘΚ
Θ®1Θ©≈®―ΈΥαΒΡΈο÷ ΒΡΝΩ≈®Ε»ΈΣ________________________ΓΘ
Θ®2Θ©≈δ÷Τ240 mL 0.1 molL©¹1ΒΡ―ΈΥα
”ΠΝΩ»Γ≈®―ΈΥαΧεΜΐ/mL | ”ЯÔϻίΝΩΤΩΒΡΙφΗώ/mL |
__________ | __________ |
Θ®3Θ©≈δ÷Τ ±Θ§Τδ’ΐ»ΖΒΡ≤ΌΉςΥ≥–ρ «Θ®”ΟΉ÷ΡΗ±μ ΨΘ§ΟΩΗωΉ÷ΡΗ÷ΜΡή”Ο“Μ¥ΈΘ©__________ΓΘ
AΘ°”Ο30 mLΥ°œ¥Β”…’±≠ΡΎ±ΎΚΆ≤ΘΝßΑτ23¥ΈΘ§œ¥Β”“ΚΨυΉΔ»κ»ίΝΩΤΩΘ§’ώΒ¥
BΘ°”ΟΝΩΆ≤Μ¥»ΖΝΩ»ΓΥυ–ηΒΡ≈®―ΈΥαΒΡΧεΜΐΘ§ΒΙ»κ…’±≠÷–Θ§‘ΌΦ”»κ…ΌΝΩΥ°Θ®‘Φ30 mLΘ©Θ§”Ο≤ΘΝßΑτ¬ΐ¬ΐΫΝΕ·Θ§ ΙΤδΜλΚœΨυ‘»
CΘ°ΫΪ“―ά以ΒΡ―ΈΥα―Ί≤ΘΝßΑτΉΔ»κ»ίΝΩΤΩ÷–
DΘ°ΫΪ»ίΝΩΤΩΗ«ΫτΘ§’ώΒ¥Θ§“Γ‘»
EΘ°ΗΡ”ΟΫΚΆΖΒΈΙήΦ”Υ°Θ§ Ι»ή“ΚΑΦ“ΚΟφ«ΓΚΟ”κΩΧΕ»œΏœύ«–
FΘ°ΦΧ–χΆυ»ίΝΩΤΩΡΎ–Γ–ΡΦ”Υ°Θ§÷±ΒΫ“ΚΟφΫ”ΫϋΩΧΕ»œΏ12 cm¥Π
Θ®4Θ©»τ Β―ι÷–”ωΒΫœ¬Ν–«ιΩωΘ§Ε‘≈δ÷Τ―ΈΥαΒΡΈο÷ ΒΡΝΩ≈®Ε»”–ΚΈ”ΑœλΘ®ΧνΓΑΤΪΗΏΓ±ΓΑΤΪΒΆΓ±ΜρΓΑ≤Μ±δΓ±Θ©
ΔΌ”Ο”ΎœΓ Ά―ΈΥαΒΡ…’±≠Έ¥œ¥Β”__________________________________________ΘΜ
ΔΎ»ίΝΩΤΩ÷–‘≠”–…ΌΝΩ’τΝσΥ°____________________________________________ΘΜ
ΔέΕ®»ί ±Η© ”Ιέ≤λ“ΚΟφ________________________________________________ΓΘ
Θ®5Θ©»τ Β―ιΙΐ≥Χ÷–≥ωœ÷»γœ¬«ιΩω»γΚΈ¥ΠάμΘΩ
ΔΌΕ®»ί ±Φ”’τΝσΥ° ±≥§ΙΐΝΥΩΧΕ»________________________________________ΘΜ
ΔΎœρ»ίΝΩΤΩ÷–ΉΣ“Τ»ή“Κ ±≤Μ…ς”–»ή“ΚΫΠ≥ω________________________________ΘΜ
ΔέΕ®»ί“Γ‘»ΚσΖΔœ÷“ΚΟφœ¬ΫΒ____________________________________________ΓΘ