题目内容
【题目】氯水中存在平衡Cl2+H2O![]() HCl+HClO,HClO
HCl+HClO,HClO![]() H++ClO-。达平衡后,要使HClO浓度增大,可加入( )
H++ClO-。达平衡后,要使HClO浓度增大,可加入( )
A.H2SB.NaHCO3C.盐酸D.NaOH
【答案】B
【解析】
A.向溶液中通入硫化氢,硫化氢和氯气发生氧化还原反应,导致平衡向逆反应方向移动,则次氯酸浓度降低,故A错误;
B.向溶液中加入NaHCO3,NaHCO3和稀盐酸反应导致平衡向正反应方向移动,次氯酸和NaHCO3不反应,所以次氯酸浓度增大,故B正确;
C.加入HCl,HCl的浓度增大,使平衡向逆反应方向移动,则次氯酸浓度降低,故C错误;
D.向溶液中加入NaOH,NaOH和HCl、HClO都反应,所以导致HClO浓度降低,故D错误;
故选B。

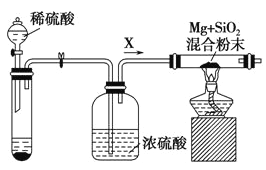
【题目】探究铁在某浓度H3PO4和H2O2的混合溶液中反应的情况,进行如下实验:
实验 | 操作 | 现象 |
Ⅰ | 将除去氧化膜的铁钉置于烧杯中,加入30 mL 1.0 mol·L1 H3PO4和 3 mL 30% H2O2的混合溶液(pH≈1)。 | 一段时间后铁钉表面突然产生大量气泡,随后停止产生气泡;一段时间后再产生大量气泡,再停止,出现周而往复的现象。过程中,溶液保持澄清。
|
Ⅱ | 将与实验Ⅰ相同的铁钉放入烧杯中,加入30 mL 1.0 mol·L1H3PO4和3 mL H2O。 | 片刻后铁钉表面持续产生气泡,溶液保持澄清。 |
已知:Fe3(PO4)2难溶于水,Fe(H2PO4)2溶于水。
(1)用85% H3PO4配制100 mL 1.0 mol·L1H3PO4所用的玻璃仪器有量筒、烧杯、玻璃棒、胶头滴管、______。
(2)实验Ⅱ中铁钉表面产生气体的化学方程式是______。
(3)探究停止产生气泡的原因。
提出假设:铁钉表面形成了含有+3价铁的氧化膜将铁钉覆盖。
甲同学进行实验Ⅲ,得出假设成立的结论。
实验Ⅲ:将洗净的实验Ⅰ中无气泡产生时的铁钉置于试管中,加入滴有KSCN溶液的稀H2SO4,振荡,静置,溶液呈红色。
乙同学认为实验Ⅲ无法证实假设成立,其理由是_____。
乙同学通过改进实验证实了假设成立。
(4)铁钉表面突然产生大量气泡的可能原因是Fe2+迅速被H2O2氧化形成氧化膜,使聚集在铁钉表面的H2脱离铁钉表面。
①实验Ⅳ证实了形成氧化膜过程中产生H+。
实验Ⅳ:______(填操作),滴入少量FeSO4溶液后,立即测定pH,pH迅速降低。
②形成氧化膜(以Fe2O3计)的离子方程式是______。
(5)实验Ⅰ中周而往复的现象与铁钉表面氧化膜的生成和溶解密切相关,从反应的速率
角度分析其原因:______。
【题目】在普通铝中加入少量Cu和Mg后,形成一种称为拉维斯相的MgCu2微小晶粒,其分散在Al中可使得铝材的硬度增加、延展性减小,形成所谓“坚铝”,是制造飞机的主要村料。回答下列问题:
(1)下列状态的镁中,电离最外层一个电子所需能量最大的是______________。
A.![]() B.
B.![]() C.
C.![]() D.
D.![]()
(2)乙二胺(H2NCH2CH2NH2)是一种有机化合物,分子中氮、碳的杂化类型分别是_________、_________。乙二胺能与Mg2+、Cu2+等金属离子形成稳定环状离子,其中与乙二胺形成的化合物稳定性相对较高的是____________(填“Mg2+”或“Cu2+”)。
(3)一些氧化物的熔点如表所示:
氧化物 | Li2O | MgO | P4O6 | SO2 |
熔点/°C | 1570 | 2800 | 23.8 | 75.5 |
解释MgO熔点比P4O6熔点高得多的原因______________
(4)金刚石的晶胞如图,若以硅原子代替金刚石晶体中的碳原子,便得到晶体硅;若将金刚石晶体中一半的碳原子换成硅原子,且碳、硅原子交替,即得到碳化硅晶体(金刚砂)
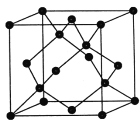
①碳化硅晶体(金刚砂)的化学式______________
②金刚石、晶体硅、碳化硅的熔点由高到低的顺序为__________________
③立方氮化硼晶体的结构与金刚石相似,硬度与金刚石相当,晶胞边长为361.5 pm。立方氮化硼的密度是_____________g/cm3(列出式子并化简,阿伏加德罗常数为NA)