题目内容
【题目】NOx(主要指NO和NO2)是大气主要污染物之一。有效去除大气中的NOx是环境保护的重要课题。
在有氧条件下,新型催化剂M能催化NH3与NOx反应生成N2。
将一定比例的O2、NH3和NOx的混合气体,匀速通入装有催化剂M的反应器中反应。
反应相同时间NOx的去除率随反应温度的变化曲线如图所示,在50~250℃范围内随着温度的升高,NOx的去除率先迅速上升后上升缓慢的主要原因是___;当反应温度高于380℃时,NOx的去除率迅速下降的原因可能是__。
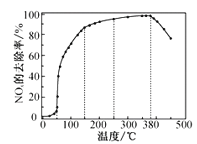
【答案】迅速上升段是催化剂活性随温度升高增大与温度升高共同使NOx去除反应速率迅速增大;上升缓慢段主要是温度升高引起的NOx去除反应速率增大,催化剂活性下降 NH3与O2反应生成了NO
【解析】
因为反应相同时间,所以低温时主要考虑温度和催化剂对化学反应速率的影响,高温时,NH3与O2发生催化氧化反应。在![]() 范围内,NOx的去除率迅速上升是催化剂活性随温度升高增大与温度升高共同使NOx去除反应速率迅速增大;上升缓慢阶段主要是温度升高引起NOx去除反应速率增大,但温度升高催化剂活性下降,反应温度高于380℃时,NOx的去除率迅速下降是因为可能NH3与O2反应生成了NO,其化学反应方程式为:4NH3+5O2
范围内,NOx的去除率迅速上升是催化剂活性随温度升高增大与温度升高共同使NOx去除反应速率迅速增大;上升缓慢阶段主要是温度升高引起NOx去除反应速率增大,但温度升高催化剂活性下降,反应温度高于380℃时,NOx的去除率迅速下降是因为可能NH3与O2反应生成了NO,其化学反应方程式为:4NH3+5O2![]() 4NO+6H2O,故答案为:迅速上升阶段是催化剂活性随温度升高增大与温度升高共同使NOx去除反应速率迅速增大;上升缓慢阶段主要是温度升高引起的NOx去除反应速率增大,催化剂活性下降;NH3与O2反应生成了NO。
4NO+6H2O,故答案为:迅速上升阶段是催化剂活性随温度升高增大与温度升高共同使NOx去除反应速率迅速增大;上升缓慢阶段主要是温度升高引起的NOx去除反应速率增大,催化剂活性下降;NH3与O2反应生成了NO。

【题目】某反应在体积为5L的恒容密闭的绝热容器中进行,各物质的量随时间的变化情况如图所示(已知A、B、C均为气体)。
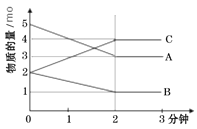
(1)该反应的化学方程式为_______。
(2)反应开始至2分钟时,B的平均反应速率为_______。
(3)由图求得平衡时A的转化率为_______。
(4)为了研究硫酸铜的量对氢气生成速率的影响,某同学设计了如下一系列的实验:将表中所给的混合溶液分别加入到6个盛有过量Zn粒的容器中,收集产生的气体,记录获得相同体积的气体所需时间。
实验混合溶液 | A | B | C | D | E | F |
4mol/L H2SO4(mL) | 30 | V1 | V2 | V3 | V4 | V5 |
饱和CuSO4溶液(mL) | 0 | 0.5 | 2.5 | 5 | V6 | 20 |
H2O(mL) | V7 | V8 | V9 | V10 | 10 | 0 |
请完成此实验设计,其中:V1=_______,V6=_______。