题目内容
9.下列排列顺序错误的是( )| A. | 非金属性:S>Cl>F | B. | 碱性:NaOH>Mg( 0H)2>Al( 0H)3 | ||
| C. | 稳定性:PH3<H2S<HF | D. | 离子半径:02->Na+>Mg2+ |
分析 A、同周期从左到右非金属性增强,同主族从上往下非金属减弱;
B、金属性越强,最高价氧化物对应水化物的碱性增加;
C、非金属性越强,氢化物越稳定;
D、电子层结构相同,核电荷数越多半径越小.
解答 解:A、同周期从左到右非金属性增强,同主族从上往下非金属减弱,所以非金属性:S<Cl<F,故A错误;
B、金属性越强,最高价氧化物对应水化物的碱性增加,金属性Na>Mg>Al,所以碱性:NaOH>Mg( 0H)2>Al( 0H)3 ,故B正确;
C、非金属性:P<S<F,氢化物越稳定为:PH3<H2S<HF,故C正确;
D、电子层结构相同,核电荷数越多半径越小,所以离子半径:02->Na+>Mg2+,故D正确;
故选A.
点评 本题考查位置、结构、性质的关系,熟悉位置及元素周期律即可解答,题目难度不大.

练习册系列答案
相关题目
5.化学在环境保护中起着十分重要的作用,电化学降解NO3-的原理如图所示.下列说法不正确的是( )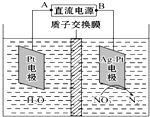

| A. | A为电源的正极 | |
| B. | 溶液中H+从阳极向阴极迁移 | |
| C. | 阴极反应式为2 NO3-+12H++10e-=N2↑+6H20 | |
| D. | 若电解过程中转移了2 mol电子,则左侧电解液的质量减少了16g |
1.天然提取和人工合成的物质往往是混合物,确定其中指定有机物分子结构的步骤是( )
| A. | 分离、提纯→确定分子式→确定实验式→确定结构式 | |
| B. | 分离、提纯→确定实验式→确定分子式→确定结构式 | |
| C. | 分离、提纯→确定结构式→确定实验式→确定分子式 | |
| D. | 确定分子式→确定实验式→确定结构式→分离、提纯 |
18.近年,我国某些地区出现了私自滥采黄金的现象,提炼过程一般要使用化学药品氰化物,其直接后果是( )①污染水体 ②破坏臭氧层 ③危害工人的生命与健康 ④破坏植被.
| A. | ①② | B. | ①②③ | C. | ②④ | D. | ①③④ |
19.下列实验操作正确的是( )
| 编号 | 实验 | 操作 |
| A | 钠与水反应 | 用镊子从煤油中去除金属钠,切下绿豆大小的钠,小心放入装满水的烧杯中 |
| B | 配制一定浓度的碳酸钠溶液1000mL | 准确称取碳酸的固体,放入到1000mL的容量瓶中,加水溶解,振荡摇匀、定容 |
| C | 排除碱式滴定管尖嘴部分的气泡 | 将胶管弯曲使玻璃尖嘴斜向上,用两指捏住胶管,轻轻挤压玻璃珠,使溶液从尖嘴流出 |
| D | 去除分液漏斗中所需的上层液体 | 下层液体从分液漏斗下端管口放出至截面上,关闭活塞,换一个接收容器,上层液体继续从分液漏斗下端放出 |
| A. | A | B. | B | C. | C | D. | D |
 .已知(CN)2是直线形分子,并具有对称性,则(CN)2中π键和σ键的个数比为4:3.
.已知(CN)2是直线形分子,并具有对称性,则(CN)2中π键和σ键的个数比为4:3.