题目内容
11.已知C5H10O能发生银镜反应,该有机物的同分异构体有( )| A. | 3种 | B. | 4种 | C. | 5种 | D. | 6种 |
分析 C5H10O能发生银镜反应,说明此物质为戊醛,C5H10O可以看做丁基代替HCHO中的H原子,所以,丁基有几种,C5H10O就有几种同分异构体.
解答 解:C5H10O能发生银镜反应,说明此物质为戊醛,C5H10O可以看做丁基代替HCHO中的H原子,丁基有四种,所以C5H10O就有四种同分异构体.
故选B.
点评 本题主要考查的是有机化合物同分异构体个数的判断,掌握碳原子数小于5的烷基是解决本题的关键,甲基和乙基均1种,丙基2种,丁基4种,戊基8种,难度不大.

练习册系列答案
相关题目
1.葡萄糖是一种单糖的理由是( )
| A. | 它不能发生分解反应 | B. | 不能再水解成更简单的糖 | ||
| C. | 分子中只含一个醛基 | D. | 葡萄糖分子中含碳原子数最少 |
2.设NA为阿伏伽德罗常数的值,下列有关叙述不正确的是( )
| A. | 标准状况下,1L庚烷完全燃烧所生成的气态产物的分子数为$\frac{7}{22.4}$NA | |
| B. | 1mol 甲基(-CH3)所含的电子总数为9NA | |
| C. | 0.5mol 1,3-丁二烯分子中含有 数为NA 数为NA | |
| D. | 1mol碳正离子(CH${\;}_{3}^{+}$)所含的电子总数为8NA |
19.正己烷是优良的有机溶剂,其球棍模型为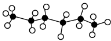 ,X是它的一种同分异构体,且X分子的主链上含有4个碳原子,下列有关说法中正确的是( )
,X是它的一种同分异构体,且X分子的主链上含有4个碳原子,下列有关说法中正确的是( )
 ,X是它的一种同分异构体,且X分子的主链上含有4个碳原子,下列有关说法中正确的是( )
,X是它的一种同分异构体,且X分子的主链上含有4个碳原子,下列有关说法中正确的是( )| A. | X分子中可能含有三个甲基 | |
| B. | X的一氯代物一定有三种 | |
| C. | 在催化剂存在下加热正己烷时可得到丁烷、丙烷、乙烯、丙烯等物质 | |
| D. | X能使溴的四氯化碳溶液褪色 |
6.下列元素中,化学性质最稳定的是 ( )
| A. | 核电荷为12的原子 | B. | 质子数为8的原子 | ||
| C. | K层为最外层时有2个电子的原子 | D. | 核电荷数为9的原子 |
3.锂被誉为“金属味精”,以LiCoO2为正极材料的锂离子电池已被广泛用作便携式电源.工业上常以β锂辉矿(主要成分为LiAlSi2O6,还含有FeO、MgO、CaO等杂质)为原料来制取金属锂.其中一种工艺流程如下: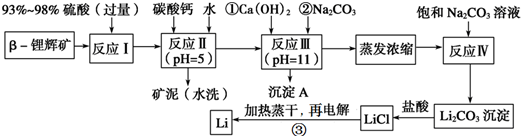
已知:部分金属氢氧化物开始沉淀和完全沉淀时的pH:
请回答下列问题:
(1)写出反应Ⅰ中有电子转移的化学方程式2FeO+4H2SO4=Fe2(SO4)3+SO2↑+H2O;
(2)反应Ⅱ加入碳酸钙的作用是除去反应Ⅰ中过量的H2SO4,控制pH,使Fe3+、Al3+完全沉淀;
(3)有同学认为在反应Ⅲ中只需加入碳酸钠溶液也能达成该步骤的目的,请阐述你的观点和理由不能,离子不能完全除去;
(4)上述流程蒸发浓缩环节,若在实验室进行该操作,当蒸发浓缩至晶体膜出现时,就可停止该操作.
(5)Li与Mg、Be与Al、B与Si这三对元素在周期表中处于对角线位置,相应的两元素及其化合物的性质有许多相似之处.这种相似性称为对角线规则.步骤③中电解时,阳极产生的氯气中会混有少量氧气,原因是加热蒸干LiCl溶液时,LiCl有少量水解生成LiOH,受热分解生成Li2O,电解时产生O2.
(6)请设计一种从水洗后的矿泥中分离出Al2O3的流程:矿泥$→_{过滤}^{足量NaOH}$滤液$\stackrel{足量二氧化碳}{→}$氢氧化铝$\stackrel{△}{→}$Al2O3(流程常用的表示方式为:A$→_{实验操作}^{反应试剂}$B…$→_{实验操作}^{反应试剂}$目标产物).

已知:部分金属氢氧化物开始沉淀和完全沉淀时的pH:
| 氢氧化物 | Fe(OH)3 | Al(OH)3 | Mg(OH)2 |
| 开始沉淀pH | 2.7 | 3.7 | 9.6 |
| 完全沉淀pH | 3.7 | 4.7 | 11 |
(1)写出反应Ⅰ中有电子转移的化学方程式2FeO+4H2SO4=Fe2(SO4)3+SO2↑+H2O;
(2)反应Ⅱ加入碳酸钙的作用是除去反应Ⅰ中过量的H2SO4,控制pH,使Fe3+、Al3+完全沉淀;
(3)有同学认为在反应Ⅲ中只需加入碳酸钠溶液也能达成该步骤的目的,请阐述你的观点和理由不能,离子不能完全除去;
(4)上述流程蒸发浓缩环节,若在实验室进行该操作,当蒸发浓缩至晶体膜出现时,就可停止该操作.
(5)Li与Mg、Be与Al、B与Si这三对元素在周期表中处于对角线位置,相应的两元素及其化合物的性质有许多相似之处.这种相似性称为对角线规则.步骤③中电解时,阳极产生的氯气中会混有少量氧气,原因是加热蒸干LiCl溶液时,LiCl有少量水解生成LiOH,受热分解生成Li2O,电解时产生O2.
(6)请设计一种从水洗后的矿泥中分离出Al2O3的流程:矿泥$→_{过滤}^{足量NaOH}$滤液$\stackrel{足量二氧化碳}{→}$氢氧化铝$\stackrel{△}{→}$Al2O3(流程常用的表示方式为:A$→_{实验操作}^{反应试剂}$B…$→_{实验操作}^{反应试剂}$目标产物).
10.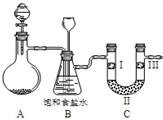 某学习小组围绕氯气设计了系列实验.
某学习小组围绕氯气设计了系列实验.
(1)用如图装置A制备氯气.选用的药品为:漂粉精固体和浓盐酸,相关的化学反应方程式为:Ca(ClO)2+4HCl(浓)═CaCl2+2Cl2↑+2H2O.实验过程中,使用分液漏斗滴加液体的操作是打开分液漏斗上口活塞(或将漏斗口活塞上的凹槽与瓶口上的小孔对齐),左手顶住漏斗球,右手转动颈部活塞控制加液.
(2)装置B中饱和食盐水的作用是除去氯气中的HCl;同时装置B亦是安全瓶,监测实验进行时C中是否发生堵塞,请写出发生堵塞时B中的现象B中长颈漏斗下端导管中液面会上升,形成水柱.
(3)为检验氯气是否具有漂白性,使氯气依次通过I、Ⅱ、Ⅲ三种物质,物质的顺序正确的是:D.
(4)为了进一步比较氧化性强弱,将一定量氯气通入溴化亚铁溶液后,再加入四氯化碳,振荡,静置,整个过程中肯定能观察到的现象是A
A.水层显棕黄色 B.水层无色 C.四氯化碳层显红棕色 D.四氯化碳层无色
(5)查阅资料后小组发现,氯气、浓硝酸、酸性高锰酸钾等都是常用的强氧化剂,但工业上氧化卤水中I-选择了价格并不便宜的亚硝酸钠,排除环境方面的因素,可能的原因是:氯气、浓硝酸、酸性高锰酸钾等氧化性太强,还能继续氧化碘单质
(6)有人提出,工业上为防止污染空气,可用足量的NaHSO3溶液吸收余氯,试写出相应的离子反应方程式:HSO3-+Cl2+H2O═SO42-+2Cl-+3H+(或4HSO3-+Cl2═SO42-+2Cl-+3SO2↑+2H2O).判断改用NaHSO3溶液是否可行:否(填“是”或“否”).
 某学习小组围绕氯气设计了系列实验.
某学习小组围绕氯气设计了系列实验.(1)用如图装置A制备氯气.选用的药品为:漂粉精固体和浓盐酸,相关的化学反应方程式为:Ca(ClO)2+4HCl(浓)═CaCl2+2Cl2↑+2H2O.实验过程中,使用分液漏斗滴加液体的操作是打开分液漏斗上口活塞(或将漏斗口活塞上的凹槽与瓶口上的小孔对齐),左手顶住漏斗球,右手转动颈部活塞控制加液.
(2)装置B中饱和食盐水的作用是除去氯气中的HCl;同时装置B亦是安全瓶,监测实验进行时C中是否发生堵塞,请写出发生堵塞时B中的现象B中长颈漏斗下端导管中液面会上升,形成水柱.
(3)为检验氯气是否具有漂白性,使氯气依次通过I、Ⅱ、Ⅲ三种物质,物质的顺序正确的是:D.
| A | B | C | D | |
| Ⅰ | 干燥的有色布条 | 干燥的有色布条 | 湿润的有色布条 | 湿润的有色布条 |
| Ⅱ | 碱石灰 | 硅胶 | 浓硫酸 | 无水氯化钙 |
| Ⅲ | 湿润的有色布条 | 湿润的有色布条 | 干燥的有色布条 | 干燥的有色布条 |
A.水层显棕黄色 B.水层无色 C.四氯化碳层显红棕色 D.四氯化碳层无色
(5)查阅资料后小组发现,氯气、浓硝酸、酸性高锰酸钾等都是常用的强氧化剂,但工业上氧化卤水中I-选择了价格并不便宜的亚硝酸钠,排除环境方面的因素,可能的原因是:氯气、浓硝酸、酸性高锰酸钾等氧化性太强,还能继续氧化碘单质
(6)有人提出,工业上为防止污染空气,可用足量的NaHSO3溶液吸收余氯,试写出相应的离子反应方程式:HSO3-+Cl2+H2O═SO42-+2Cl-+3H+(或4HSO3-+Cl2═SO42-+2Cl-+3SO2↑+2H2O).判断改用NaHSO3溶液是否可行:否(填“是”或“否”).
7.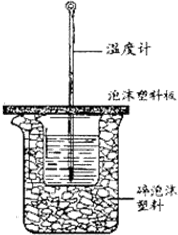 用50mL0.50mol/L盐酸与50mL0.55mol/LNaOH溶液在如图所示的装置中进行中和反应.通过测定反应过程中所放出的热量可计算中和热.回答下列问题:
用50mL0.50mol/L盐酸与50mL0.55mol/LNaOH溶液在如图所示的装置中进行中和反应.通过测定反应过程中所放出的热量可计算中和热.回答下列问题:
(1)从实验装置上看,图中尚缺少的一种玻璃用品是环形玻璃搅拌棒.
(2)烧杯间填满碎纸条或塑料泡沫的作用是减少实验过程中的热量损失.
(3)利用本次实验数据计算所得中和热为-54.3kJ/mol (盐酸和NaOH溶液的密度按1g•cm-3,反应后混合溶液的热容按4.18J•g-1•℃-1计算).
(4)已知中和热△H=-57.36kJ/mol,你认为造成上述误差的原因可能是BC.
A.在量取盐酸时仰视读数
B.把量筒中的氢氧化钠倒入小烧杯时动作迟缓
C.大烧杯上未盖硬纸板
(5)大烧杯上如不盖硬纸板,求得的中和热的绝对值偏小(填“偏大”、“偏小”或“无影响”).
(6)如果用60mL0.50mol/L盐酸与50mL0.55mol/LNaOH溶液进行反应,与上述实验相比,所放出的热量不相等(填“相等、不相等”),所求中和热相等(填“相等”或“不相等”).
(7)用相同浓度和体积的氨水(NH3•H2O)代替NaOH溶液进行上述实验,测得的中和热的绝对值会偏小(填“偏大”、“偏小”或“无影响”).
 用50mL0.50mol/L盐酸与50mL0.55mol/LNaOH溶液在如图所示的装置中进行中和反应.通过测定反应过程中所放出的热量可计算中和热.回答下列问题:
用50mL0.50mol/L盐酸与50mL0.55mol/LNaOH溶液在如图所示的装置中进行中和反应.通过测定反应过程中所放出的热量可计算中和热.回答下列问题:(1)从实验装置上看,图中尚缺少的一种玻璃用品是环形玻璃搅拌棒.
(2)烧杯间填满碎纸条或塑料泡沫的作用是减少实验过程中的热量损失.
| 起始温度T1/℃ | 终止温度 T2/℃ | ||
| HCl | NaOH | ||
| 1 | 25.1 | 25.2 | 28.4 |
| 2 | 25.1 | 25.2 | 28.3 |
| 3 | 25.1 | 25.2 | 28.5 |
(4)已知中和热△H=-57.36kJ/mol,你认为造成上述误差的原因可能是BC.
A.在量取盐酸时仰视读数
B.把量筒中的氢氧化钠倒入小烧杯时动作迟缓
C.大烧杯上未盖硬纸板
(5)大烧杯上如不盖硬纸板,求得的中和热的绝对值偏小(填“偏大”、“偏小”或“无影响”).
(6)如果用60mL0.50mol/L盐酸与50mL0.55mol/LNaOH溶液进行反应,与上述实验相比,所放出的热量不相等(填“相等、不相等”),所求中和热相等(填“相等”或“不相等”).
(7)用相同浓度和体积的氨水(NH3•H2O)代替NaOH溶液进行上述实验,测得的中和热的绝对值会偏小(填“偏大”、“偏小”或“无影响”).