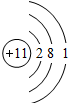题目内容
10.将铁粉、铜粉、氯化铁溶液、氯化亚铁溶液和氯化铜溶液,混合于容积合适的烧杯内,充分反应后,试填写下列空白.(1)若铁粉有剩余,则溶液中不可能有的离子是Fe3+、Cu2+(从Fe3+、Cu2+、Fe2+中选填).
(2)若溶液中氯化铁和氯化铜都有剩余,则不可能有的金属单质是Fe、Cu(从Fe、Cu中选填).
分析 Fe、Cu加入到氯化铁、氯化亚铁和氯化铜的混合溶液中,还原性Fe>Cu,氧化性Fe3+>Cu2+>Fe2+,发生2Fe3++Fe=3Fe2+,Fe+Cu2+=Fe2++Cu,Cu+2Fe3+=2Fe2++Cu2+,以此解答该题.
解答 解:(1)铁粉有剩余,则Cu不参加反应,发生2Fe3++Fe=3Fe2+,Fe+Cu2+=Fe2++Cu,溶液中不可能有Fe3+、Cu2+,故答案为:Fe3+、Cu2+;
(2)若溶液中氯化铁和氯化铜都有剩余,Fe、Cu均可与氯化铁反应,说明金属不足,即不可能有的金属单质是Fe、Cu,故答案为:Fe、Cu.
点评 本题考查元素化合物知识,题目侧重于铁的性质的考查,题目难度不大,注意相关基础知识的积累,答题时注意还原性的强弱及反应的先后顺序.

练习册系列答案
相关题目
20.下列反应中,可以发生消去反应的是( )
| A. | 溴乙烷与NaOH水溶液混合加热 | |
| B. | 甲醇与浓硫酸混合加热 | |
| C. | 乙醇与浓硫酸混合加热 | |
| D. | 2-溴丁烷与NaOH的乙醇溶液混合加热 |
1.葡萄糖是一种单糖的理由是( )
| A. | 它不能发生分解反应 | B. | 不能再水解成更简单的糖 | ||
| C. | 分子中只含一个醛基 | D. | 葡萄糖分子中含碳原子数最少 |
18.下列离子方程式书写正确的是( )
| A. | 小苏打和盐酸反应:CO32-+2H+═CO2↑+H2O | |
| B. | AlCl3溶液中加入足量的氨水:Al3++3OH-═Al(OH)3↓ | |
| C. | 三氯化铁溶液中加入铁粉 Fe3++Fe═2Fe2+ | |
| D. | 氢氧化铝溶于强碱:Al(OH)3+OH-═AlO2-+2H2O |
15.下列反应的离子方程式,书写错误的是( )
| A. | 钠放入水中:Na+2H+=2Na++H2↑ | |
| B. | 铜粉放入硝酸银溶液里:Cu+2Ag+=Cu2++2Ag | |
| C. | 氢氧化钡跟硫酸铜溶液的反应:Ba2++2OH-+Cu2++SO2-4=BaSO4↓+Cu(OH)2↓ | |
| D. | 氯化铁溶液中滴加硝酸银溶液:Cl-+Ag+=AgCl↓ |
2.设NA为阿伏伽德罗常数的值,下列有关叙述不正确的是( )
| A. | 标准状况下,1L庚烷完全燃烧所生成的气态产物的分子数为$\frac{7}{22.4}$NA | |
| B. | 1mol 甲基(-CH3)所含的电子总数为9NA | |
| C. | 0.5mol 1,3-丁二烯分子中含有 数为NA 数为NA | |
| D. | 1mol碳正离子(CH${\;}_{3}^{+}$)所含的电子总数为8NA |
19.正己烷是优良的有机溶剂,其球棍模型为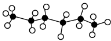 ,X是它的一种同分异构体,且X分子的主链上含有4个碳原子,下列有关说法中正确的是( )
,X是它的一种同分异构体,且X分子的主链上含有4个碳原子,下列有关说法中正确的是( )
 ,X是它的一种同分异构体,且X分子的主链上含有4个碳原子,下列有关说法中正确的是( )
,X是它的一种同分异构体,且X分子的主链上含有4个碳原子,下列有关说法中正确的是( )| A. | X分子中可能含有三个甲基 | |
| B. | X的一氯代物一定有三种 | |
| C. | 在催化剂存在下加热正己烷时可得到丁烷、丙烷、乙烯、丙烯等物质 | |
| D. | X能使溴的四氯化碳溶液褪色 |
7.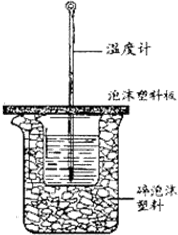 用50mL0.50mol/L盐酸与50mL0.55mol/LNaOH溶液在如图所示的装置中进行中和反应.通过测定反应过程中所放出的热量可计算中和热.回答下列问题:
用50mL0.50mol/L盐酸与50mL0.55mol/LNaOH溶液在如图所示的装置中进行中和反应.通过测定反应过程中所放出的热量可计算中和热.回答下列问题:
(1)从实验装置上看,图中尚缺少的一种玻璃用品是环形玻璃搅拌棒.
(2)烧杯间填满碎纸条或塑料泡沫的作用是减少实验过程中的热量损失.
(3)利用本次实验数据计算所得中和热为-54.3kJ/mol (盐酸和NaOH溶液的密度按1g•cm-3,反应后混合溶液的热容按4.18J•g-1•℃-1计算).
(4)已知中和热△H=-57.36kJ/mol,你认为造成上述误差的原因可能是BC.
A.在量取盐酸时仰视读数
B.把量筒中的氢氧化钠倒入小烧杯时动作迟缓
C.大烧杯上未盖硬纸板
(5)大烧杯上如不盖硬纸板,求得的中和热的绝对值偏小(填“偏大”、“偏小”或“无影响”).
(6)如果用60mL0.50mol/L盐酸与50mL0.55mol/LNaOH溶液进行反应,与上述实验相比,所放出的热量不相等(填“相等、不相等”),所求中和热相等(填“相等”或“不相等”).
(7)用相同浓度和体积的氨水(NH3•H2O)代替NaOH溶液进行上述实验,测得的中和热的绝对值会偏小(填“偏大”、“偏小”或“无影响”).
 用50mL0.50mol/L盐酸与50mL0.55mol/LNaOH溶液在如图所示的装置中进行中和反应.通过测定反应过程中所放出的热量可计算中和热.回答下列问题:
用50mL0.50mol/L盐酸与50mL0.55mol/LNaOH溶液在如图所示的装置中进行中和反应.通过测定反应过程中所放出的热量可计算中和热.回答下列问题:(1)从实验装置上看,图中尚缺少的一种玻璃用品是环形玻璃搅拌棒.
(2)烧杯间填满碎纸条或塑料泡沫的作用是减少实验过程中的热量损失.
| 起始温度T1/℃ | 终止温度 T2/℃ | ||
| HCl | NaOH | ||
| 1 | 25.1 | 25.2 | 28.4 |
| 2 | 25.1 | 25.2 | 28.3 |
| 3 | 25.1 | 25.2 | 28.5 |
(4)已知中和热△H=-57.36kJ/mol,你认为造成上述误差的原因可能是BC.
A.在量取盐酸时仰视读数
B.把量筒中的氢氧化钠倒入小烧杯时动作迟缓
C.大烧杯上未盖硬纸板
(5)大烧杯上如不盖硬纸板,求得的中和热的绝对值偏小(填“偏大”、“偏小”或“无影响”).
(6)如果用60mL0.50mol/L盐酸与50mL0.55mol/LNaOH溶液进行反应,与上述实验相比,所放出的热量不相等(填“相等、不相等”),所求中和热相等(填“相等”或“不相等”).
(7)用相同浓度和体积的氨水(NH3•H2O)代替NaOH溶液进行上述实验,测得的中和热的绝对值会偏小(填“偏大”、“偏小”或“无影响”).