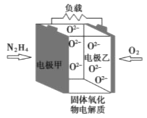
题目内容
【题目】为应对石油短缺,一碳化学研究备受关注。一碳化学是指以分子中只含一个碳原子的化合物如甲醇、一氧化碳等为原料,制造产品的化学体系的总称。
(1)CH3OH(g)和NH3(g)在一定条件下反应可制得甲胺CH3NH2(g)。
![]()
![]()
①已知该反应中相关的化学键键能数据如下:
共价键 | C—O | N—H | C—N | C—H |
E/(kJ/mol) | a | b | c | d |
则H—O键的键能为_________________kJ/mol(用含有字母的代数式表示)
②在某恒容密闭容器中进行该反应,其他条件不变的情况下,分别测得起始时CH3OH(g)的物质的量和温度对平衡时CH3NH2(g)的体积分数的影响,如图所示:(图中T1、T2表示温度)

则T1_________T2(填“>”、“<”或“=”);____________(填“a”、“b”或“c”)点对应的平衡状态中反应物NH3(g)的转化率最大。b、d两点的平衡常数大小关系为Kb________Kd(填“>”、“<”或“=”)。
(2)甲醇在工业上可利用水煤气来合成:![]() 。将1mol CO和2mol H2通入密闭容器中进行反应,在一定温度和压强下达到平衡时甲醇的体积分数
。将1mol CO和2mol H2通入密闭容器中进行反应,在一定温度和压强下达到平衡时甲醇的体积分数![]() (CH3OH)变化趋势如图所示:
(CH3OH)变化趋势如图所示:

图中Y轴表示的外界条件为________________,判断的理由是______________________。
已知v(正)=k(正)·p(CO)·p(H2)2,v(逆)=k(逆)·p(CH3OH),其中k(正)、k(逆)分别为正、逆反应速率常数,p为各组分的分压。在M点所处的温度(T3℃)和压强(p0kPa)下,反应在20分钟达到平衡时![]() (CH3OH)=10%,该温度下反应的平常数KP=____________kPa-2(用平衡分压代替平衡浓度计算,分压=总压×物质的量分数)。若在15分钟时
(CH3OH)=10%,该温度下反应的平常数KP=____________kPa-2(用平衡分压代替平衡浓度计算,分压=总压×物质的量分数)。若在15分钟时![]() ,此时
,此时![]() ______________(计算结果保留两位小数)
______________(计算结果保留两位小数)
【答案】12+a+b-c > c > 温度 反应为放热反应,升高温度,可使平衡向逆反应方向移动,使![]() (CH3OH)减小
(CH3OH)减小 ![]() 3.03
3.03
【解析】
反应放出的热量=成键释放的能量-断键吸收的能量;根据图象可知,随起始时CH3OH(g)的物质的量的增加,平衡时CH3NH2(g)的体积分数先增加后减小,平衡常数仅与温度有关;反应![]() 为放热反应、气体分子数减小的反应。
为放热反应、气体分子数减小的反应。
(1) ①根据反应![]() 断裂了碳氧键、氮氢键,形成了碳氮键和氧氢键,设H—O键的键能为x,断键吸收的能量为(a+b) kJ/mol,成键释放的能量为(c+x)kJ/mol,则
断裂了碳氧键、氮氢键,形成了碳氮键和氧氢键,设H—O键的键能为x,断键吸收的能量为(a+b) kJ/mol,成键释放的能量为(c+x)kJ/mol,则![]() ,解得x=12+a+b-c。
,解得x=12+a+b-c。
②当起始时CH3OH(g)的物质的量相同时,T1温度下平衡时CH3NH2(g)的体积分数小于T2温度下平衡时CH3NH2(g)的体积分数,因该反应为放热反应,升高温度平衡逆向移动,故T1>T2;起始时CH3OH(g)的物质的量越大,平衡正移,NH3(g)的转化率越大,则c点NH3(g)的转化率最大;平衡常数仅与温度有关,因反应为放热反应,温度越大,平衡常数越小,故b的平衡常数大于d点的。
(2)该反应为放热反应,温度升高,平衡逆移,平衡时甲醇的体积分数减小,故Y轴表示的外界条件为温度;相同条件下,气体的体积分数等于气体的物质的量分数,设平衡时甲醇的物质的量为x,则反应生成甲醇为xmol,消耗CO x mol,消耗H22xmol,平衡时CO为(1-x)mol,H2为(2-2x)mol, ![]() ,解得x=0.25mol,CO平衡分压=
,解得x=0.25mol,CO平衡分压=![]() ,H2平衡分压=
,H2平衡分压=![]() ,甲醇平衡分压=
,甲醇平衡分压=![]() ,则KP=
,则KP=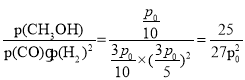 kPa-2;因为v(正)=k(正)·p(CO)·p(H2)2,v(逆)=k(逆)·p(CH3OH),当v(正)= v(逆)时,
kPa-2;因为v(正)=k(正)·p(CO)·p(H2)2,v(逆)=k(逆)·p(CH3OH),当v(正)= v(逆)时,![]() ,则在15分钟
,则在15分钟![]() 时,
时,
![]()
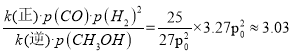 。
。

【题目】如图所示测定溶液导电性实验的装置,甲与乙中盛有浓度相同的不同液体。接通电源后将甲中液体逐滴滴入乙中,发现灯泡由亮→暗灭→亮。下表中甲、乙所盛液体符合要求的是( )

选项 | 甲 | 乙 |
A | 氯化钠溶液 | 硝酸银溶液 |
B | 氨水 | 醋酸 |
C | 稀盐酸 | 碳酸钙悬浊液 |
D | 硫酸铜溶液 | 氢氧化钡溶液 |
A.AB.BC.CD.D