题目内容
某课题组进行实验研究时,欲配制浓度均为1.0mol?L-1 的Ba(OH)2和H2SO4溶液。
Ⅰ.该组同学在配制Ba(OH)2溶液时,只找到在空气中暴露已久的Ba(OH)2·8H2O试剂(相对分子质量:315),发现所取试剂在水中仅部分溶解,烧杯中存在大量未溶物。
(1)用化学方程式解释未溶物产生的原因
(2)某同学查得Ba(OH)2·8H2O在283K、293K和303K时的溶解度(g/100g H2O)分别为2.5、3.9和5.6。据此认为即便使用纯净的Ba(OH)2·8H2O,在室温下也不能配得1.0 mol?L-1Ba(OH)2溶液,其理由是:
Ⅱ.用18 mol?L-1的浓硫酸配制450 mL 1.0 mol?L-1稀硫酸。
(3)实验时,需量取浓硫酸的体积为 mL,需用的主要仪器有量筒、烧杯、玻璃棒、 、
(4)配制溶液时,定容的操作方法是:
(5)实验中下列情况会使所配溶液浓度偏高的是
| A.洗涤量取浓硫酸的量筒2~3次,并将洗涤液转入容量瓶中 |
| B.定容时仰视刻度线 |
| C.振荡摇匀后再重新加水至刻度线 |
| D.用水洗涤容量瓶未干燥 |
(1)Ba(OH)2+CO2 =BaCO3+H2O(2分)
(2)室温下,Ba(OH)2饱和溶液的浓度只约为0.12 mol?L-1(2分)
(3) 27.8(2分),胶头滴管、500 mL容量瓶(2分)
(4)加水离刻度线1~2 cm,改用胶头滴管逐滴滴加至刻度线(2分)
(5) A (2分)
解析试题分析:(1)长期放在空气中氢氧化钡会与二氧化碳反应生成碳酸钡而出现浑浊。(2)室温下,溶解度为3.9g/100g水。n=".9g/315g/mol=0.012mol" 10000g水中应该溶解0.12mol,假设密度是1g/ml,所以浓度大约0.12mol/L,达不到1mol/L。(3)只能用500ml的容量瓶配置无450ml的容量瓶。所需主要仪器有量筒、烧杯、玻璃棒、胶头滴管、500 mL容量瓶.(4)定容的操作方法是加水离刻度线1~2 cm,改用胶头滴管逐滴滴加至凹液面与刻度线相切。(5)量取浓硫酸的量筒不需要洗涤,制备量筒时误差已经考虑,否则溶质偏多结果偏高。仰视刻度线使加水多,所以浓度偏低。洗涤容量瓶没有干燥无影响。
考点:本题考查配置溶液时的具体操作和有关浓度的计算问题。

 期末100分闯关海淀考王系列答案
期末100分闯关海淀考王系列答案 小学能力测试卷系列答案
小学能力测试卷系列答案在花瓶中加入“鲜花保鲜剂”,能延长鲜花的寿命。
(1)现有一种无色的鲜花营养液,可能由硝酸钙、碳酸钾、硝酸钾、氯化钾中的一种或几种物质组成,为探究其成分,某同学设计并完成了如下图所示的实验。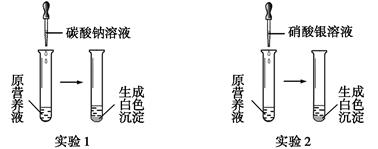
根据以上实验,请你填空。
①由实验1可确定原营养液中一定没有的物质是 (填化学式),写出生成白色沉淀的离子方程式是 。
②若测得原营养液中K+、Cl-的数目之比为2∶1,则原营养液是由 种溶质配制成的。
③某同学用氯化钙、硝酸钾、氯化钾配成的营养液中K+、Cl-、NO3-的数目之比为2∶5∶1,
则所用硝酸钾和氯化钙的物质的量之比是 。
(2)下表是500mL某“鲜花保鲜剂”中含有的成分,阅读后回答下列问题。
| 成分 | 质量(g) | 摩尔质量(g ·mol-1) |
| 蔗糖 | 68.4 | 342 |
| 硫酸钾 | 0.50 | 174 |
| 阿司匹林 | 0.35 | 180 |
| 高锰酸钾 | 0.50 | 158 |
| 硝酸银 | 0.04 | 170 |
①“鲜花保鲜剂”中蔗糖的物质的量浓度为___________________。
②配制该500mL “鲜花保鲜剂”所需的玻璃仪器除了烧杯、玻璃棒、量筒外还有 。
③在溶液配制过程中,下列操作能使配制结果偏小的是___________。
A.定容时仰视容量瓶刻度线
B.容量瓶在使用前未干燥,里面有少量蒸馏水
C.移液时,液体不小心从外壁流出
D.定容摇匀后发现液面低于容量瓶的刻度线,但未做任何处理
某草酸盐晶体KxFey(C2O4)z?wH2O中铁为+3价,草酸根为-2价,且知x+y+z=7。取该晶体做了以下实验:
① 取4.910g晶体在不同温度下加热至恒重,所得固体的化学式和质量如下表:
| | 120℃ | 300℃ | 480℃ |
| 化学式 | KxFey(C2O4)z | KxFeyO(C2O4)z-1 | KxFeyO2(C2O4)z-2 |
| 质量 | 4.370g | 3.650g | 2.930 g |
② 另取4.910g晶体,经过加酸溶解、加足量碱沉淀、灼烧至恒重,铁元素全部转化为Fe2O3,质量为0.800g。
(1)计算得出草酸盐晶体中结晶水的质量分数为 (保留三位小数);
(2)R的化学式为 ;
(3)草酸盐晶体的摩尔质量为 ;
(4)试通过计算,确定草酸盐晶体的化学式。
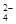 ,SO
,SO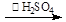
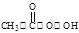 (过氧乙酸)+H2O
(过氧乙酸)+H2O