题目内容
在花瓶中加入“鲜花保鲜剂”,能延长鲜花的寿命。
(1)现有一种无色的鲜花营养液,可能由硝酸钙、碳酸钾、硝酸钾、氯化钾中的一种或几种物质组成,为探究其成分,某同学设计并完成了如下图所示的实验。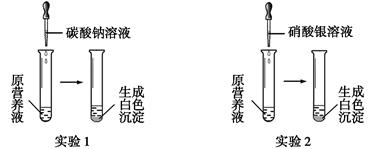
根据以上实验,请你填空。
①由实验1可确定原营养液中一定没有的物质是 (填化学式),写出生成白色沉淀的离子方程式是 。
②若测得原营养液中K+、Cl-的数目之比为2∶1,则原营养液是由 种溶质配制成的。
③某同学用氯化钙、硝酸钾、氯化钾配成的营养液中K+、Cl-、NO3-的数目之比为2∶5∶1,
则所用硝酸钾和氯化钙的物质的量之比是 。
(2)下表是500mL某“鲜花保鲜剂”中含有的成分,阅读后回答下列问题。
| 成分 | 质量(g) | 摩尔质量(g ·mol-1) |
| 蔗糖 | 68.4 | 342 |
| 硫酸钾 | 0.50 | 174 |
| 阿司匹林 | 0.35 | 180 |
| 高锰酸钾 | 0.50 | 158 |
| 硝酸银 | 0.04 | 170 |
①“鲜花保鲜剂”中蔗糖的物质的量浓度为___________________。
②配制该500mL “鲜花保鲜剂”所需的玻璃仪器除了烧杯、玻璃棒、量筒外还有 。
③在溶液配制过程中,下列操作能使配制结果偏小的是___________。
A.定容时仰视容量瓶刻度线
B.容量瓶在使用前未干燥,里面有少量蒸馏水
C.移液时,液体不小心从外壁流出
D.定容摇匀后发现液面低于容量瓶的刻度线,但未做任何处理
(1)①碳酸钾; Ca2++CO32-=CaCO3↓ ②3 ③1:2
(2)①0.4 mol?L-1 ②500ml容量瓶、胶头滴管 ③AC
解析试题分析:(1)①向营养液中加入碳酸钠溶液产生白色沉淀,说明营养液中含有硝酸钙,不能含有碳酸钾。它们会发生离子反应。生成白色沉淀的离子方程式是Ca2++CO32-=CaCO3↓。②由于原营养液中K+、Cl-的数目之比为2∶1,不含碳酸钾,KCl中二者的比是1:1,原物质含有钾不含氯的物质只可能是硝酸钾。故原营养液是由有硝酸钙、硝酸钾、氯化钾三种物质配制而成。③由氯化钙、硝酸钾、氯化钾配成的营养液中,K+、Cl-、NO3-的数目之比为2∶5∶1,假设n(NO3-)=1mol,则n(KNO3)="1" mol,,n(KCl)=1mol,n(CaCl2)=2mol。所以n(KNO3): n(CaCl2)=1:2。(2)①C(蔗糖)=(68.4g∕342g·mol-1)∕0.5L="0.4" mol?L-1.准确配制500ml一定浓度的溶液需500ml要容量瓶及胶头滴管。③在溶液配制过程中A.定容时仰视容量瓶刻度线,加水过多,浓度偏低,正确。B.容量瓶在使用前未干燥,里面有少量蒸馏水,后来加入的水就少些,但最终量没变,所以浓度没变化。错误。。所以C.在移液时,液体不小心从外壁流出,会导致溶质减少。浓度偏低。正确。D.溶液的特性是均一性、稳定性。若定容摇匀后发现液面低于容量瓶的刻度线,但未做任何处理。不会产生任何影响。错误。故导致浓度偏小的是AC。
考点:考查离子反应一定体积、一定物质的量浓度的溶液的配制时应该注意的问题和误差分析等的知识。

某课题组进行实验研究时,欲配制浓度均为1.0mol?L-1 的Ba(OH)2和H2SO4溶液。
Ⅰ.该组同学在配制Ba(OH)2溶液时,只找到在空气中暴露已久的Ba(OH)2·8H2O试剂(相对分子质量:315),发现所取试剂在水中仅部分溶解,烧杯中存在大量未溶物。
(1)用化学方程式解释未溶物产生的原因
(2)某同学查得Ba(OH)2·8H2O在283K、293K和303K时的溶解度(g/100g H2O)分别为2.5、3.9和5.6。据此认为即便使用纯净的Ba(OH)2·8H2O,在室温下也不能配得1.0 mol?L-1Ba(OH)2溶液,其理由是:
Ⅱ.用18 mol?L-1的浓硫酸配制450 mL 1.0 mol?L-1稀硫酸。
(3)实验时,需量取浓硫酸的体积为 mL,需用的主要仪器有量筒、烧杯、玻璃棒、 、
(4)配制溶液时,定容的操作方法是:
(5)实验中下列情况会使所配溶液浓度偏高的是
| A.洗涤量取浓硫酸的量筒2~3次,并将洗涤液转入容量瓶中 |
| B.定容时仰视刻度线 |
| C.振荡摇匀后再重新加水至刻度线 |
| D.用水洗涤容量瓶未干燥 |
(10分)按要求填空:
(1)以下物质:①NH3 ②CaCO3 ③酒精 ④饱和食盐水 ⑤Cu ⑥KOH ⑦HCl属于电解质的有 (填编号);
(2)14.7gH2SO4分子所含氢原子数与 L (标准状况下)NH3所含氢原子数相等;
(3)固体NaCl(I2)(括号内的物质为杂质),除去杂质的方法为 。
(4)要除去某食盐晶体中的CaCl2、MgCl2、Na2SO4等杂质,有以下操作:
| A.蒸发结晶 | B.过滤 | C.加入过量的Na2CO3溶液 | D.加水溶解 E、加入过量的烧碱溶液 F、加入过量稀盐酸 G、加入过量的Ba(NO3)2溶液 H、加入过量的稀硝酸 I、加入过量的BaCl2溶液 |
标准状况下,1体积水中能溶解500体积的HCl气体。若向1 L水中通入标准状况下的448LHCl气体,假设气体完全溶解。
(1)若所得溶液密度为1.2 g/cm3,则溶液中含HCl物质的量浓度为 ;
(2)从该溶液中取出10mL浓盐酸溶解于水配制成500mL溶液,配制后的稀溶液中含HCl物质的量浓度为 。
(3)在用浓盐酸配制上述稀盐酸时,所用仪器中,使用前必须检查是否漏液的仪器有 ;配制过程中,造成浓度偏低的操作可能有_______________(选填下列操作的序号)。
| A.容量瓶蒸馏水洗后未加干燥 |
| B.量筒用蒸馏水洗后未干燥 |
| C.将烧杯中浓盐酸移入容量瓶后,未用水洗涤烧杯,即向容量中加水到刻度 |
| D.用胶头滴管向容量瓶中加水时,不慎超过刻度线,用另外胶头滴管从瓶中吸出部分溶液使剩余溶液刚巧达刻度线 |
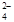 + 2Fe2+ + 4H+
+ 2Fe2+ + 4H+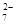 + 6 Fe2+ + 14 H+ →2 Cr3+ + 6 Fe3+ + 7 H2O
+ 6 Fe2+ + 14 H+ →2 Cr3+ + 6 Fe3+ + 7 H2O