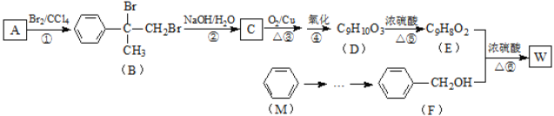
题目内容
【题目】下列说法中不正确的是( )
弱酸 | CH3COOH | HClO | H2CO3 |
电离平衡常数(25℃) | K1=1.760×10-5 | K1=2.95×10-8 | K1=4.30×10-7 K2=5.60×10-11 |
A.pH相同的①CH3COONa ②NaHCO3③NaClO三种溶液中c(Na+):③<②<①
B.一定浓度的NaHS溶液中:c(Na+)+c(H+)=c(OH-)+c(HS-)+2c(S2-)
C.pH=a的氨水,稀释至原体积的10倍后,其pH=b,则b>a-1
D.少量的![]() 通入NaClO溶液中发生反应:
通入NaClO溶液中发生反应:![]()
【答案】D
【解析】
A.根据表格可知醋酸酸性最强,次氯酸酸性最弱,越弱盐类水解规律越弱越水解可得,pH相同的①CH3COONa ②NaHCO3③NaClO三种溶液中c(Na+):③<②<①,A项正确,不符合题意;
B.根据电荷守恒可知应有NaHS溶液中:c(Na+)+c(H+)=c(OH-)+c(HS-)+2c(S2-),B项正确,不符合题意;
C.氨水是弱电解质,稀释会向电离方向移动,所以pH=a的氨水,稀释至原体积的10倍后,其pH=b,则b>a-1,C项正确,不符合题意;
D.根据表格可知,次氯酸的电离平衡常数大于碳酸的二级电离平衡常数,所以少量的CO2通入NaClO溶液中发生反应应为:![]() ,D项错误,符合题意;
,D项错误,符合题意;
答案选D。

【题目】最近科学家提出“绿色自由”构想:把含有大量CO2的空气吹入碳酸钾溶液中,再把CO2从溶液中提取出来,并使之与氢气反应生成可再生能源甲醇。其工艺流程如图所示:
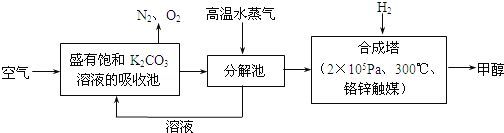
(1)写出分解池中反应的化学方程式为_______________;
(2)在合成塔中,若有4.4kg CO2与足量H2恰好完全反应,生成气态的水和甲醇,可放出4947kJ的热量,试写出该反应的热化学方程式_______________;
(3)已知合成塔中的反应是可逆的,根据平衡移动原理,低温有利于原料气的转化,而实际生产中采用300℃的温度,其原因可能是_______________;
(4)“绿色自由”构想流程中常包括物质的“循环利用”,上述流程中能体现“循环利用”的物质除碳酸钾溶液外,还包括________(化学式)。
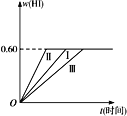
(5)300℃时,将CO和H2按1:3的体积比充入密闭容器中,CO2的平衡转化率(α)与体系总压强(p)的关系如图所示。根据图示回答下列问题:
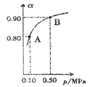
①若其他条件不变,将A点的体积压缩至原来的一半,一段时间后反应再达平衡是,与原平衡比较下列说法正确的是________。
A.CO2的浓度减小 |
B.正反应速率增大,逆反应速率减小 |
C.CO2和H2的体积比为1:3 |
D.CH3OH的体积分数增大 |
②将1.0molCO2和3.0molH2置于体积不变的密闭容器中,2min时反应达到平衡,此时体系总压强为0.10MPa,用H2表示的反应速率为1.2mol/(L·min),则密闭容器的体积是____L。
(6)甲醇可制作燃料电池。以氢氧化钾溶液为电解质的负极反应式是__________。当转移的电子的物质的量为_______mol时,参加反应的氧气的体积是6.72L(标准状况下)。