题目内容
【题目】某同学为了探究锌与盐酸反应过程中的速率变化,他在100mL稀盐酸中加入足量的锌粉,用排水集气法收集反应放出的氢气(气体体积已折算为标准状况下的体积),实验记录如下(累计值):
时间/min | 1 | 2 | 3 | 4 | 5 |
氢气体积/mL | 50 | 120 | 232 | 290 | 310 |
(1)反应速率最大的时间段是__(填“0~1min”“1~2min”“2~3min”或“4~5min”),原因是__。
(2)反应速率最小的时间段是__(填“0~1min”“1~2min”“2~3min”或“4~5min”),原因是__。
(3)2~3min时间段内,以盐酸的浓度变化表示该反应的速率为__。
(4)如果反应太剧烈,为了减缓反应速率而又不减少产生氢气的量,该同学在盐酸中分别加入等体积的下列液体,你认为可行的是__(填序号)。
A.蒸馏水 B.NaCl溶液 C.Na2CO3溶液 D.CuSO4溶液
【答案】2~3min 该反应是放热反应,2~3min时间段内温度较高 4~5min 4~5min时间段内H+浓度较低 0.1mol·L-1·min-1 AB
【解析】
根据表格数据可得:“0~1min”产生氢气的量为50mL,“1~2min”产生氢气的量为120mL-50mL=70mL,“2~3min”产生氢气的量为232mL-120mL=112mL,“4~5min”产生的氢气的量为310mL-290mL=20mL,再根据公式![]() 分析解答问题。
分析解答问题。
(1)反应速率最大,则单位时间内产生的氢气最多,“2~3min”产生氢气的量为232mL-120mL=112mL,又因该反应是放热反应,此时间段内温度较高,故答案为:2~3min;该反应是放热反应,2~3min时间段内温度较高;
(2)速率最小,即单位内产生的氢气最少,4~5min共产生20mL氢气,主要原因是随着反应的进行,此时间段内H+浓度较低,故答案为:4~5min;4~5min时间段内H+浓度较低;
(3) 根据公式![]() ,“2~3min”产生氢气的量为232mL-120mL=112mL,则
,“2~3min”产生氢气的量为232mL-120mL=112mL,则![]() ,根据方程式:Zn+2HCl===ZnCl2+H2↑可知,消耗
,根据方程式:Zn+2HCl===ZnCl2+H2↑可知,消耗![]() 的物质的量n(HCl)=2n(H2)=0.01mol,然后再根据
的物质的量n(HCl)=2n(H2)=0.01mol,然后再根据![]() 可求得盐酸的反应速率
可求得盐酸的反应速率![]() ,故答案为0.1 mol·L-1·min-1;
,故答案为0.1 mol·L-1·min-1;
(4)加入蒸馏水和NaCl溶液相当于降低盐酸浓度,反应速率减小,加入Na2CO3溶液,会消耗盐酸,则会减少生成氢气的量,CuSO4溶液会消耗锌,会减少生成氢气的量,且反应放热会增大反应速率,故答案选AB。

【题目】温度为T 时,向2.0 L恒容密闭容器中充入1.0 mol PCl5,
反应:PCl5(g)![]() PCl3(g)+Cl2(g)经一段时间后达到平衡,反应过程中测定的部分数据见下表:
PCl3(g)+Cl2(g)经一段时间后达到平衡,反应过程中测定的部分数据见下表:
t/s | 0 | 50 | 150 | 250 | 250 |
n(PCl3)/mol | 0 | 0.16 | 0.19 | 0.20 | 0.20 |
下列说法正确的是
A. 反应在前50 s内的平均速率v(PCl3)=0.0032mol/(L·s)
B. 保持其他条件不变,升高温度,平衡时c(PCl3)=0.11mol/L,该反应为放热反应
C. 相同温度下,起始时向容器中充入1.0 mol PCl5、0.20 mol PCl3和0.20 mol Cl2,达到平衡前的v正>v逆
D. 相同温度下,起始时向容器中充入2.0 mol PCl3、2.0 mol Cl2,达到平衡时,PCl3的转化率小于80%
【题目】实验室以苯甲醛为原料制备间溴苯甲醛的反应如下:
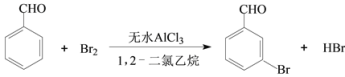
已知:(1)间溴苯甲醛温度过高时易被氧化。
(2)溴、苯甲醛、1,2-二氯乙烷、间溴苯甲醛的沸点见下表:
物质 | 溴 | 苯甲醛 | 1,2-二氯乙烷 | 间溴苯甲醛 |
沸点/℃ | 58.8 | 179 | 83.5 | 229 |
步骤1:将一定配比的无水AlCl3、1,2-二氯乙烷和苯甲醛充分混合后装入三颈烧瓶(如右图所示),缓慢滴加经浓硫酸干燥过的足量液溴,控温反应一段时间,冷却。

步骤2:将反应混合物缓慢加入一定量的稀盐酸中,搅拌、静置、分液。有机层用10% NaHCO3溶液洗涤。
步骤3:经洗涤的有机层加入适量无水MgSO4固体,放置一段时间后过滤出
MgSO4nH2O晶体。
步骤4:减压蒸馏有机层,收集相应馏分。
(1)实验装置中冷凝管的主要作用是_____,锥形瓶中应为_____(填化学式)溶液。
(2)步骤1反应过程中,为提高原料利用率,适宜的温度范围为(填序号)_______。
A.>229℃ B.58.8℃~179℃ C.<58.8℃
(3)步骤2中用10% NaHCO3溶液洗涤,是为了除去溶于有机层的___(填化学式)。
(4)步骤3中加入无水MgSO4固体的作用是_____。
(5)步骤4中采用减压蒸馏,是为了防止______。
(6)若实验中加入了5.3 g苯甲醛,得到3.7 g间溴苯甲醛。则间溴苯甲醛产率为______。

