题目内容
16.有下列四种溶液:①HCl ②AlCl3 ③NaOH ④Na2CO3,此四种溶液中水的电离度分别为α1、α2、α3、α4,已知α1=α3,α2=α4,且$\frac{{α}_{2}}{{α}_{1}}$=106,则四种溶液的pH值不可能是( )| A. | 5、5、10、10 | B. | 4、4、10、10 | C. | 3、5、11、9 | D. | 5、3、9、11 |
分析 H2O?H++OH-,①HCl为强酸,抑制水的电离; ②AlCl3为强酸弱碱盐,促进水的电离; ③NaOH为强碱,抑制水的电离; ④Na2CO3为强碱弱酸盐,促进水的电离;
α1=α3,HCl与NaOH对水的电离的抑制程度相等,即PH1+PH3=14,α2=α4,PH2+PH4=14,对水的电离的促进程度相等,①中的水的电离受到抑制,②中水的电离受到促进,
且$\frac{{α}_{2}}{{α}_{1}}$=106,则(14-pH2)-pH1=6,将各选项数据代入即可,据此分析解答.
解答 解:纯水中存在电离平衡:H2O?OH-+H+,加入酸或者碱能够抑制水的电离,使水的电离程度减小;若加入弱酸根离子或者弱碱根离子,能够促进水的电离,①HCl为强酸,抑制水的电离; ②AlCl3为强酸弱碱盐,促进水的电离; ③NaOH为强碱,抑制水的电离; ④Na2CO3为强碱弱酸盐,促进水的电离;电离的水分子物质的量与未电离前水分子物质的量的比即是水的电离度,水电离的氢离子浓度等于氢氧根离子浓度,α1=α3,HCl与NaOH对水的电离的抑制程度相等,即两种溶液中水的电离程度相等,即PH1+PH3=14,同理α2=α4,PH2+PH4=14,且$\frac{{α}_{2}}{{α}_{1}}$=106,(14-pH2)-pH1=6,
A.PH1+PH3=14,5+10=15,不符合,PH2+PH4=14,5+10=15,不符合,(14-5)-5=4,不符合,故A选;
B.PH1+PH3=14,4+10=14,符合,PH2+PH4=14,4+10=14,符合,(14-4)-4=6,符合,故B不选;
C.PH1+PH3=14,3+11=14,符合,PH2+PH4=14,5+9=14,符合,(14-5)-3=6,符合,故C不选;
D.PH1+PH3=14,5+9=14,符合,PH2+PH4=14,3+11=14,符合,(14-3)-5=6,符合,故D不选;
故选A.
点评 本题考查水的电离,理解α1=α3,α2=α4,且$\frac{{α}_{2}}{{α}_{1}}$=106,得出PH1+PH3=14,PH2+PH4=14,(14-pH2)-pH1=6是解答关键,也可用举例法推出关系式,题目难度中等.

 各地期末复习特训卷系列答案
各地期末复习特训卷系列答案 小博士期末闯关100分系列答案
小博士期末闯关100分系列答案| A. | 0.2mol | B. | 0.4 mol | C. | 0.6 mol | D. | 0.8 mol |
| A. | Mg | B. | Al | C. | Zn | D. | Cu |
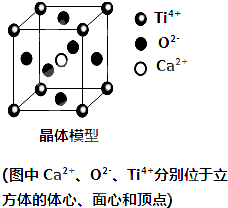
| A. | 该晶体的化学式为CaTiO3 | |
| B. | 晶体中每个Ti4+和12个Ca2+相紧邻 | |
| C. | 该晶胞中含有8个Ti4+,6个O2-和一个Ca2+ | |
| D. | 该晶体的溶沸点较低 |
| A. | Na原子结构示意图: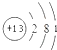 | B. | Cl-结构示意图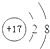 | ||
| C. | O的原子结构示意图: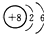 | D. | Al3+结构示意图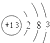 |

 .以下对苯甲酸钠描述错误的是C.
.以下对苯甲酸钠描述错误的是C.