题目内容
1.当燃烧8.96升由CH4、CO、C2H6组成的混和气体时,除生成水外,还生成17.92升CO2气体(气体体积均在标准状况下测定).则原混和气体中含C2H6的物质的量是( )| A. | 0.2mol | B. | 0.4 mol | C. | 0.6 mol | D. | 0.8 mol |
分析 根据碳元素守恒V(CO2)=V(CH4)+V(CO)+2V(C2H6)=[V(CH4)+V(CO)+V(C2H6)]+V(C2H6)=8.96L+V(C2H6),据此计算原混合气体中C2H6的体积,再根据n=$\frac{V}{{V}_{m}}$计算出混合气体中C2H6的物质的量.
解答 解:根据碳元素守恒可知:V(CO2)=V(CH4)+V(CO)+2V(C2H6),则:17.92LL=[V(CH4)+V(CO)+V(C2H6)]+V(C2H6)=8.96L+V(C2H6),原混合气体中V(C2H6)=17.92L-8.96L=8.96L,
则原混和气体中含C2H6的物质的量为:$\frac{8.96L}{22.4L/mol}$=0.4mol,
故选B.
点评 本题考查混合物的有关计算,题目难度中等,根据体积变化确定原混合气体中C2H6的体积是关键,也可以利用差量法计算,试题培养了学生分析能力及化学计算能力.

练习册系列答案
 中考解读考点精练系列答案
中考解读考点精练系列答案
相关题目
11.关于反应CaO+3C→CaC2+CO,下面哪种表述能最好地说明该反应是一个氧化还原反应( )
| A. | CaO失氧变为CaC2 | B. | C的状态发生了变化 | ||
| C. | Ca的化合价在反应前后发生了改变 | D. | C失去了电子,同时也得到了电子 |
12.下列物质之间的反应,一定不能生成盐的是( )
| A. | 酸性氧化物与碱反应 | B. | 碱性氧化物与酸反应 | ||
| C. | 单质与化合物的置换反应 | D. | 金属与氧气化合 |
9.下列说法正确的是( )
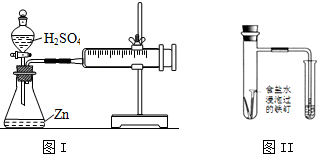

| A. | 用润湿的pH试纸测定0.1mol/L氨水的pH值 | |
| B. | 在CaCO3饱和溶液中,加入Na2CO3固体,平衡时c(Ca2+)=c(CO${\;}_{3}^{2-}$)=$\sqrt{{K}_{sp}CaC{O}_{3}}$ | |
| C. | 图I装置可用于探究浓度对化学反应速率的影响 | |
| D. | 观察图II导管中水柱的变化,可知该条件下铁钉主要发生了析氢腐蚀 |
16.有A、B、C、D、E五种前四周期元素,其元素特征信息如表:
回答下列问题:
(1)元素C在周期表中的位置为第3周期ⅠA族.
(2)B基态原子的核外电子排布图 ;E基态原子的电子排布式1s22s22p63s23p63d54s1.
;E基态原子的电子排布式1s22s22p63s23p63d54s1.
(3)写出化合物A2B2的电子式 .
.
(4)D的氢氧化物与化合物CBA反应的离子方程式Al(OH)3+OH-=AlO2-+2H2O.
(5)B与C(碳)、N(氮)相比,第一电离能由大到小的顺序为N>O>C.
| 元素编号 | 元素特征信息 |
| A | 其单质是密度最小的物质 |
| B | 阴离子带两个单位负电荷,单质是空气的主要成分之一 |
| C | 其阳离子与B的阴离子有相同的电子层结构,电离能(I)数据依次为:I1=490kJ/mol-1,I2=4562kJ/mol-1,I3=6912kJ/mol-1… |
| D | 其氢氧化物和氧化物都有两性,与C同周期 |
| E | 在第四周期元素原子中,其所含不成对电子数最多 |
(1)元素C在周期表中的位置为第3周期ⅠA族.
(2)B基态原子的核外电子排布图
 ;E基态原子的电子排布式1s22s22p63s23p63d54s1.
;E基态原子的电子排布式1s22s22p63s23p63d54s1.(3)写出化合物A2B2的电子式
 .
.(4)D的氢氧化物与化合物CBA反应的离子方程式Al(OH)3+OH-=AlO2-+2H2O.
(5)B与C(碳)、N(氮)相比,第一电离能由大到小的顺序为N>O>C.
13.下列有关化学反应速率的说法正确的是( )
| A. | 用铁片和稀硫酸反应制取氢气时,改用98%的浓硫酸可以加快产生氢气的速率 | |
| B. | 100 mL 2 mol•L-1的盐酸跟锌片反应,加入适量的氯化钠溶液,反应速率不变 | |
| C. | SO2的催化氧化是一个放热反应,升高反应的温度,反应速率减慢 | |
| D. | 用锌和稀硫酸反应制取H2时,滴加几滴硫酸铜溶液能加快反应速率 |
10.下列说法中正确的是( )
| A. | 升高温度,反应速率可能减小 | |
| B. | 需要加热的反应一定为吸热反应 | |
| C. | 使用催化剂不能使化学平衡发生移动 | |
| D. | 使某金属做电解池的阳极,可使该金属得到有效的保护 |
16.有下列四种溶液:①HCl ②AlCl3 ③NaOH ④Na2CO3,此四种溶液中水的电离度分别为α1、α2、α3、α4,已知α1=α3,α2=α4,且$\frac{{α}_{2}}{{α}_{1}}$=106,则四种溶液的pH值不可能是( )
| A. | 5、5、10、10 | B. | 4、4、10、10 | C. | 3、5、11、9 | D. | 5、3、9、11 |