题目内容
11.如图为某晶体的晶胞,下列说法正确的是( )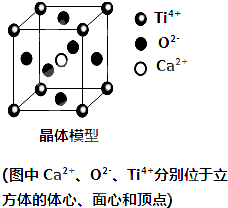
| A. | 该晶体的化学式为CaTiO3 | |
| B. | 晶体中每个Ti4+和12个Ca2+相紧邻 | |
| C. | 该晶胞中含有8个Ti4+,6个O2-和一个Ca2+ | |
| D. | 该晶体的溶沸点较低 |
分析 A、利用均摊法计算;
B、Ti4+位于晶胞顶点上被8个晶胞共用,据此答题;
C、利用均摊法计算;
D、离子晶体的熔沸点较高,据此答题.
解答 解:A、Ca2+位于晶胞内部,全部属于该晶胞,Ti4+位于晶胞立方体的顶点,则晶胞中含有的Ti4+个数为$\frac{1}{8}$×8=1,含有O2-个数为$\frac{1}{2}$×6=3,则该晶体的化学式为CaTiO3,故A正确;
B、Ti4+位于晶胞顶点上被8个晶胞共用,每个晶胞含有一个Ca2+,则晶体中每个Ti4+和8个Ca2+相紧邻,故B错误;
C、由A项分析可知,该晶胞中含有1个Ti4+,3个O2-和1个Ca2+,故C错误;
D、该晶体属于离子晶体,离子晶体的熔沸点较高,故D错误;
故选A.
点评 本题主要考查分子的结构及晶体结构与性质,难度不大,注意把握均摊法在晶胞计算中的应用,注重基础知识的考查.

练习册系列答案
相关题目
16.有A、B、C、D、E五种前四周期元素,其元素特征信息如表:
回答下列问题:
(1)元素C在周期表中的位置为第3周期ⅠA族.
(2)B基态原子的核外电子排布图 ;E基态原子的电子排布式1s22s22p63s23p63d54s1.
;E基态原子的电子排布式1s22s22p63s23p63d54s1.
(3)写出化合物A2B2的电子式 .
.
(4)D的氢氧化物与化合物CBA反应的离子方程式Al(OH)3+OH-=AlO2-+2H2O.
(5)B与C(碳)、N(氮)相比,第一电离能由大到小的顺序为N>O>C.
| 元素编号 | 元素特征信息 |
| A | 其单质是密度最小的物质 |
| B | 阴离子带两个单位负电荷,单质是空气的主要成分之一 |
| C | 其阳离子与B的阴离子有相同的电子层结构,电离能(I)数据依次为:I1=490kJ/mol-1,I2=4562kJ/mol-1,I3=6912kJ/mol-1… |
| D | 其氢氧化物和氧化物都有两性,与C同周期 |
| E | 在第四周期元素原子中,其所含不成对电子数最多 |
(1)元素C在周期表中的位置为第3周期ⅠA族.
(2)B基态原子的核外电子排布图
 ;E基态原子的电子排布式1s22s22p63s23p63d54s1.
;E基态原子的电子排布式1s22s22p63s23p63d54s1.(3)写出化合物A2B2的电子式
 .
.(4)D的氢氧化物与化合物CBA反应的离子方程式Al(OH)3+OH-=AlO2-+2H2O.
(5)B与C(碳)、N(氮)相比,第一电离能由大到小的顺序为N>O>C.
17.下列微粒中:①12Mg2+ ②Na2-③ ④O2-,核外电子总数相同的是( )
④O2-,核外电子总数相同的是( )
 ④O2-,核外电子总数相同的是( )
④O2-,核外电子总数相同的是( )| A. | ②③④ | B. | ①②④ | C. | ①②③ | D. | ①③④ |
16.有下列四种溶液:①HCl ②AlCl3 ③NaOH ④Na2CO3,此四种溶液中水的电离度分别为α1、α2、α3、α4,已知α1=α3,α2=α4,且$\frac{{α}_{2}}{{α}_{1}}$=106,则四种溶液的pH值不可能是( )
| A. | 5、5、10、10 | B. | 4、4、10、10 | C. | 3、5、11、9 | D. | 5、3、9、11 |
20.下列过程不发生化学变化的是( )
| A. | 石油的分馏 | B. | 煤的干馏 | ||
| C. | 以海水为原料获取单质溴 | D. | 蛋白质溶液中滴加硫酸铜 |
1. 请回答下列问题:
请回答下列问题:
(1)下表列出了一些化学键的键能E:
反应H2(g)+$\frac{1}{2}$O2(g)═H2O(g)△H=-241.8kJ•mol-1,则x=496.4.
(2)铅蓄电池是正极板上覆盖有PbO2,负极板上覆盖有Pb,电解质溶液是H2SO4溶液,电池放电时的总反应:Pb+PbO2+2H2SO4═2PbSO4+2H2O.
请写出充电时阴极的电极反应式:PbSO4+2e-═Pb+SO42-
(3)反应m A+n B?p C,在某温度下达到平衡.
①若A、B、C都是气体,减压后正反应速率小于逆反应速率,则m、n、p的关系是m+n>p.
②若C为气体,且m+n=p,在加压时化学平衡发生移动,则平衡必定向逆反应方向移动.
③若再升高温度,平衡向逆向移动,则正反应为放热反应(填“吸热”或“放热”)
(4)依据氧化还原反应Zn(s)+Cu2+(aq)═Zn2+(aq)+Cu(s)设计的原电池如图所示.
①请在图中标出电极材料及电解质溶液(写化学式)
②盐桥中的Cl-向左极移动(填“左”或“右”).
 请回答下列问题:
请回答下列问题:(1)下表列出了一些化学键的键能E:
| 化学键 | H-H | O═O | O-H |
| E/kJ•mol-1 | 436 | x | 463 |
(2)铅蓄电池是正极板上覆盖有PbO2,负极板上覆盖有Pb,电解质溶液是H2SO4溶液,电池放电时的总反应:Pb+PbO2+2H2SO4═2PbSO4+2H2O.
请写出充电时阴极的电极反应式:PbSO4+2e-═Pb+SO42-
(3)反应m A+n B?p C,在某温度下达到平衡.
①若A、B、C都是气体,减压后正反应速率小于逆反应速率,则m、n、p的关系是m+n>p.
②若C为气体,且m+n=p,在加压时化学平衡发生移动,则平衡必定向逆反应方向移动.
③若再升高温度,平衡向逆向移动,则正反应为放热反应(填“吸热”或“放热”)
(4)依据氧化还原反应Zn(s)+Cu2+(aq)═Zn2+(aq)+Cu(s)设计的原电池如图所示.
①请在图中标出电极材料及电解质溶液(写化学式)
②盐桥中的Cl-向左极移动(填“左”或“右”).
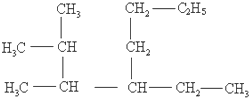 (1)3-甲基-2-乙基-1-丁烯的结构简式:
(1)3-甲基-2-乙基-1-丁烯的结构简式: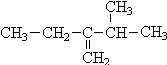
 材料是人类赖以生存和发展的重要物质基础.
材料是人类赖以生存和发展的重要物质基础.