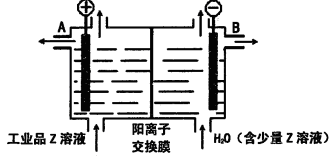
题目内容
X、Y、Z、Q、M为常见的短周期元素,其原子序数依次增大。有关信息如下表:
| X | 动植物生长不可缺少的元素,是蛋白质的重要成分 |
| Y | 地壳中含量居第一位 |
| Z | 短周期中其原子半径最大 |
| Q | 生活中大量使用其合金制品,工业上可用电解其氧化物的方法制备 |
| M | 海水中大量富集的元素之一,其最高正化合价与负价的代数和为6 |
(2)已知37Rb和53I都位于第五周期,分别与Z和M同一主族。下列有关说法正确的是____________(填序号)。
A.原子半径:Rb>I
B.RbM中含有共价键
C.气态氢化物热稳定性:M>I
D.Rb、Q、M的最高价氧化物对应的水化物可以两两发生反应
(3)X、Y组成的一种无色气体遇空气变为红棕色。将标准状况下40 L该无色气体与15 L氧气通入一定浓度的NaOH溶液中,恰好被完全吸收,同时生成两种盐。请写出该反应的离子方程式 。
(1) 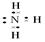
(2)A C D(有错不得分,答对2个得1分,全对得2分)
(3)8NO + 3O2 + 8OH- = 2NO3- +6NO2- + 4H2O(3分)
解析试题分析:X、Y、Z、Q、M为常见的短周期元素,其原子序数依次增大,X动植物生长不可缺少的元素,是蛋白质的重要成分,X为氮元素,Y是地壳中含量居第一位的元素,Y为氧元素,Z是短周期中原子半径最大的元素,Z为钠元素,Q是生活中大量使用其合金制品,工业上可用电解其氧化物的方法制备,Q为铝元素,M为海水中大量富集的元素之一,其最高正化合价与负价的代数和为6,M为氯元素;(1)氨气的电子式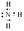 ;(2)A、根据同周期元素原子半径由左向右逐渐减小知,原子半径:Rb>I,正确 ;B、RbCl中的化学键为离子键,不含有共价键,错误;C、根据同主族由上到下元素气态氢化物热稳定性逐渐减弱知,气态氢化物热稳定性:Cl>I,正确;D、氢氧化铝为两性氢氧化物,既能与强酸反应,又能与强碱反应质子,Rb、Al、Cl的最高价氧化物对应的水化物可以两两发生反应,正确,选ACD;(3)X、Y组成的一种无色气体遇空气变为红棕色,为NO,根据题意反应的离子方程式为8NO + 3O2 + 8OH- = 2NO3- +6NO2- + 4H2O。
;(2)A、根据同周期元素原子半径由左向右逐渐减小知,原子半径:Rb>I,正确 ;B、RbCl中的化学键为离子键,不含有共价键,错误;C、根据同主族由上到下元素气态氢化物热稳定性逐渐减弱知,气态氢化物热稳定性:Cl>I,正确;D、氢氧化铝为两性氢氧化物,既能与强酸反应,又能与强碱反应质子,Rb、Al、Cl的最高价氧化物对应的水化物可以两两发生反应,正确,选ACD;(3)X、Y组成的一种无色气体遇空气变为红棕色,为NO,根据题意反应的离子方程式为8NO + 3O2 + 8OH- = 2NO3- +6NO2- + 4H2O。
考点:考查元素推断及元素周期律。

练习册系列答案
 双基同步导航训练系列答案
双基同步导航训练系列答案 黄冈小状元同步计算天天练系列答案
黄冈小状元同步计算天天练系列答案
相关题目
A、B、C、D、E、F、G、H是元素周期表前四周期常见元素,且原子序数依次增大,其相关信息如下表:
| 元素 | 相关信息 |
| A | 原子核外有6种不同运动状态的电子 |
| C | 基态原子中s电子总数与p电子总数相等 |
| D | 原子半径在同周期元素中最大 |
| E | 基态原子最外层电子排布式为3s23p1 |
| F | 基态原子的最外层p轨道有两个电子的自旋方向与其它电子的自旋方向相反 |
| G | 基态原子核外有7个能级且能量最高的能级上有6个电子 |
| H | 是我国使用最早的合金中的最主要元素 |
请用化学用语填空:
(1)A元素位于元素周期表第 周期 族,B元素和C元素的第一电离能比较,较大的是 ,C元素和F元素的电负性比较,较小的是 。
(2)B元素与宇宙中含量最丰富的元素形成的最简单化合物的分子构型为 ,
B元素所形成的单质分子中σ键与π键数目之比为 。
(3)G元素的低价阳离子的离子结构示意图是_____________,F元素原子的价电子构型的电子排布图(轨道表示式)是__________________,H元素的基态原子核外电子排布式是 。
(4)G的高价阳离子的溶液与H单质反应的离子方程式为 ;
与E元素成对角关系的某元素的最高价氧化物的水化物具有两性,写出该两性物质与D元素的最高价氧化物的水化物反应的化学方程式为 。
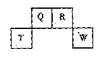
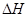 = ( 注:题中所涉单质均为最稳定单质)。
= ( 注:题中所涉单质均为最稳定单质)。
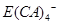 的形式存在,写出E溶于Z溶液的离子方程式:_________________________________________.
的形式存在,写出E溶于Z溶液的离子方程式:_________________________________________.