题目内容
【题目】影响化学反应速率的因素很多,某课外兴趣小组用实验的方法进行探究。
实验一:他们利用Cu、Fe、Mg和不同浓度的硫酸(0.5mol/L、2mol/L、18.4mol/L),设计实验方案来研究影响反应速率的因素。
甲同学研究的实验报告如下表:
实 验 步 骤 | 现 象 | 结 论 |
①分别取等体积的2 mol/L硫酸于试管中; | 反应快慢: | 反应物的性质越活泼, |
(1)该同学的实验目的是_________________________________________;
要得出正确的实验结论,还需控制的实验条件是_____________。
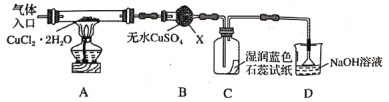
(2)乙同学为了更精确地研究浓度对反应速率的影响,利用下图装置进行定量实验。完成该实验应选用的实验药品可以是(从题中所给药品中挑选)_________________________________________________________;
实验二:
已知: 2KMnO4+5H2C2O4+3H2SO4= K2SO4+2MnSO4+8H2O+10CO2↑,在高锰酸钾酸性溶液和草酸溶液反应时,发现开始一段时间,反应速率较慢,溶液褪色不明显;但不久突然褪色,反应速率明显加快。
(1)针对上述实验现象,某同学认为KMnO4与H2C2O4反应是放热反应,导致溶液温度升高,反应速率加快。从影响化学反应速率的因素看,你的猜想还可能是_______________的影响。
(2)若用实验证明你的猜想,除酸性高锰酸钾溶液、草酸溶液试剂外,还需要选择的试剂最合理的是__________________。
A.硫酸钾 B.硫酸锰 C.氯化锰 D.水
【答案】反应物本身的性质对反应速率的关系 温度相同 Mg(或Fe)、0.5mol/L硫酸和2mol/L硫酸 催化剂(或硫酸锰或Mn2+的催化作用) B
【解析】
对于不同的反应来说,反应速率由反应物本身决定。对不同反应,浓度、温度、催化剂会影响反应速率。
实验一:(1)根据实验步骤可知,实验目的是验证反应物本身的性质对反应速率的关系。为了得到正确的实验结论,就必须保证其它实验条件是相同的,即实验时溶液的温度必须相同。
(2)根据装置图可判断,反应中产生气体,且反应不需要加热。所以是活泼的金属和稀硫酸的反应制取氢气的。铜和稀硫酸不反应,所以选择的试剂是Mg(或Fe)、0.5mol/L硫酸和2mol/L硫酸。
实验二:(1)根据影响反应速率的因素可知,能使反应速率加快的除了温度、浓度等之外,还有催化剂。
(2)根据反应的产物可判断,能起催化剂作用的应该是硫酸锰或Mn2+,所以最合理的试剂应该是选项B。

【题目】溶液X中含有下表离子中的某5种,且其浓度均为0.1 mol·L1(不考虑水的电离与离子水解)。向X溶液中加入足量稀盐酸,有无色气体生成,经分析,反应前后阴离子种类没有变化。下列叙述不正确的是( )
阳离子 | 阴离子 |
Na+、Fe3+、Fe2+、Mg2+ | NO3-、HCO3-、CO32-、SO42-、Cl- |
A.X溶液中一定含Fe3+、Fe2+
B.X溶液中不可能含有HCO3-或CO32-
C.生成无色气体的离子方程式为:3Fe2+ +NO3-+4H+===3Fe3++NO ↑ +2H2O
D.根据电荷守恒,原溶液中一定含Mg2+