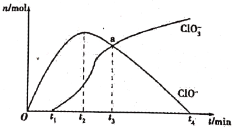
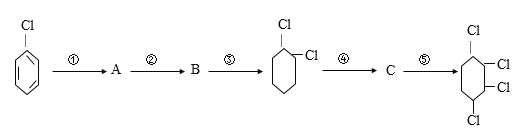
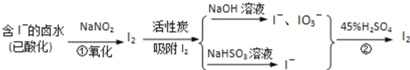
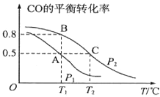
题目内容
【题目】溶液X中含有下表离子中的某5种,且其浓度均为0.1 mol·L1(不考虑水的电离与离子水解)。向X溶液中加入足量稀盐酸,有无色气体生成,经分析,反应前后阴离子种类没有变化。下列叙述不正确的是( )
阳离子 | 阴离子 |
Na+、Fe3+、Fe2+、Mg2+ | NO3-、HCO3-、CO32-、SO42-、Cl- |
A.X溶液中一定含Fe3+、Fe2+
B.X溶液中不可能含有HCO3-或CO32-
C.生成无色气体的离子方程式为:3Fe2+ +NO3-+4H+===3Fe3++NO ↑ +2H2O
D.根据电荷守恒,原溶液中一定含Mg2+
【答案】A
【解析】
各种离子的物质的量浓度均为0.1mol/L,向溶液X中加入足量的盐酸,有气体生成,且阴离子种类不变,若是![]() 或
或![]() ,则阴离子种类会改变,所以溶液不可能有
,则阴离子种类会改变,所以溶液不可能有![]() 、
、![]() ;根据表中的离子,可以推知是
;根据表中的离子,可以推知是![]() 、
、![]() 在酸性环境下生成一氧化氮,加入盐酸,溶液中阴离子种类不变,所以原来溶液中含有
在酸性环境下生成一氧化氮,加入盐酸,溶液中阴离子种类不变,所以原来溶液中含有![]() ,若只含有
,若只含有![]() 和
和![]() ,二者的浓度为0.1mol/L,根据电荷守恒是不可能的,所以还含有阴离子
,二者的浓度为0.1mol/L,根据电荷守恒是不可能的,所以还含有阴离子![]() ,由于总共含有5种离子,再根据电荷守恒可知还含有一种带有两个正电荷的
,由于总共含有5种离子,再根据电荷守恒可知还含有一种带有两个正电荷的![]() ,所以原溶液中含有的五种离子为:
,所以原溶液中含有的五种离子为:![]() 、
、![]() 、
、![]() 、
、![]() 、
、![]() ,以此解答该题。
,以此解答该题。
A.溶液中一定有![]() ,根据电荷守恒,无
,根据电荷守恒,无![]() ,故A错误;
,故A错误;
B.有气体生成,且阴离子种类不变,若是![]() 或
或![]() ,则阴离子种类会改变,所以溶液不可能有
,则阴离子种类会改变,所以溶液不可能有![]() 、
、![]() ,故B正确;
,故B正确;
C.在酸性条件下,![]() 、
、![]() 发生氧化还原反应:3Fe2+ +NO3-+4H+===3Fe3++NO ↑ +2H2O,故C正确;
发生氧化还原反应:3Fe2+ +NO3-+4H+===3Fe3++NO ↑ +2H2O,故C正确;
D.根据电荷守恒定律,阴离子![]() ,已确定的阳离子有
,已确定的阳离子有![]() ,还含有一种带有两个正电荷的
,还含有一种带有两个正电荷的![]() ,故D正确;
,故D正确;
答案选A。

 怎样学好牛津英语系列答案
怎样学好牛津英语系列答案【题目】影响化学反应速率的因素很多,某课外兴趣小组用实验的方法进行探究。
实验一:他们利用Cu、Fe、Mg和不同浓度的硫酸(0.5mol/L、2mol/L、18.4mol/L),设计实验方案来研究影响反应速率的因素。
甲同学研究的实验报告如下表:
实 验 步 骤 | 现 象 | 结 论 |
①分别取等体积的2 mol/L硫酸于试管中; | 反应快慢: | 反应物的性质越活泼, |
(1)该同学的实验目的是_________________________________________;
要得出正确的实验结论,还需控制的实验条件是_____________。
(2)乙同学为了更精确地研究浓度对反应速率的影响,利用下图装置进行定量实验。完成该实验应选用的实验药品可以是(从题中所给药品中挑选)_________________________________________________________;
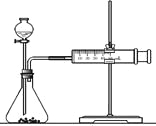
实验二:
已知: 2KMnO4+5H2C2O4+3H2SO4= K2SO4+2MnSO4+8H2O+10CO2↑,在高锰酸钾酸性溶液和草酸溶液反应时,发现开始一段时间,反应速率较慢,溶液褪色不明显;但不久突然褪色,反应速率明显加快。
(1)针对上述实验现象,某同学认为KMnO4与H2C2O4反应是放热反应,导致溶液温度升高,反应速率加快。从影响化学反应速率的因素看,你的猜想还可能是_______________的影响。
(2)若用实验证明你的猜想,除酸性高锰酸钾溶液、草酸溶液试剂外,还需要选择的试剂最合理的是__________________。
A.硫酸钾 B.硫酸锰 C.氯化锰 D.水
【题目】硼镁泥是一种工业废料,主要成份是MgO(占40%),还有CaO、MnO、Fe2O3、FeO、Al2O3、SiO2等杂质,以此为原料制取的硫酸镁,可用于印染、造纸、医药等工业。从硼镁泥中提取MgSO4·7H2O的流程如下:
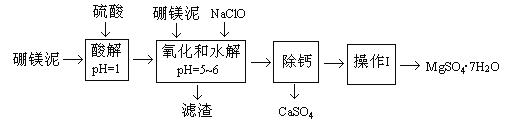
根据题意回答下列问题:
(1)实验中需用1mol/L的硫酸80mL,若用98%的浓硫酸来配制,除量筒、玻璃棒外,还需要的玻璃仪器有_________。
(2)滤渣的主要成份除含有Fe(OH)3、Al(OH)3、MnO2外,还有_________。
(3)加入的NaClO可与Mn2+反应产生MnO2沉淀,该反应的离子方程式_________。在调节pH=5-6之前,还有一种离子也会被NaClO氧化,该反应的离子方程式为________________。
(4)如何检验滤液中Fe3+是否被除尽,简述检验方法_________。
(5)已知MgSO4、CaSO4的溶解度如下表:
温度(℃) | 40 | 50 | 60 | 70 |
MgSO4 | 30.9 | 33.4 | 35.6 | 36.9 |
CaSO4 | 0.210 | 0.207 | 0.201 | 0.193 |
“除钙”是将MgSO4和CaSO4混合溶液中的CaSO4除去,根据上表数据,简要说明操作步骤_________、_________。
(6)如果提供的硼镁泥共100 g,得到的MgSO4·7H2O 196.8 g,则MgSO4·7H2O的产率为_________。