题目内容
【题目】1 mol H—H键的键能是436kJ,1 mol I—I键的键能是151kJ,1 mol H—I键的键能是299kJ,则对反应H2(g)+I2(g)![]() 2HI(g)的说法,不正确的是 ( )
2HI(g)的说法,不正确的是 ( )
A.放热反应B.吸热反应C.化合反应D.可逆反应
【答案】B
【解析】
在H2(g)+I2(g)![]() 2HI(g)中,断裂1mol H-H键吸收436kJ的能量,断裂1mol I-I键吸收的能量是151kJ,共吸收的能量为:436kJ+151kJ=587kJ,生成2molHI,共形成2molH-I键,共放出的能量为:299kJ×2=598kJ,吸收的能量少,放出的能量多,该反应为放热反应,由方程式可知该反应为化合反应和可逆反应。
2HI(g)中,断裂1mol H-H键吸收436kJ的能量,断裂1mol I-I键吸收的能量是151kJ,共吸收的能量为:436kJ+151kJ=587kJ,生成2molHI,共形成2molH-I键,共放出的能量为:299kJ×2=598kJ,吸收的能量少,放出的能量多,该反应为放热反应,由方程式可知该反应为化合反应和可逆反应。
故选B。

【题目】影响化学反应速率的因素很多,某课外兴趣小组用实验的方法进行探究。
实验一:他们利用Cu、Fe、Mg和不同浓度的硫酸(0.5mol/L、2mol/L、18.4mol/L),设计实验方案来研究影响反应速率的因素。
甲同学研究的实验报告如下表:
实 验 步 骤 | 现 象 | 结 论 |
①分别取等体积的2 mol/L硫酸于试管中; | 反应快慢: | 反应物的性质越活泼, |
(1)该同学的实验目的是_________________________________________;
要得出正确的实验结论,还需控制的实验条件是_____________。
(2)乙同学为了更精确地研究浓度对反应速率的影响,利用下图装置进行定量实验。完成该实验应选用的实验药品可以是(从题中所给药品中挑选)_________________________________________________________;
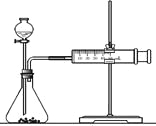
实验二:
已知: 2KMnO4+5H2C2O4+3H2SO4= K2SO4+2MnSO4+8H2O+10CO2↑,在高锰酸钾酸性溶液和草酸溶液反应时,发现开始一段时间,反应速率较慢,溶液褪色不明显;但不久突然褪色,反应速率明显加快。
(1)针对上述实验现象,某同学认为KMnO4与H2C2O4反应是放热反应,导致溶液温度升高,反应速率加快。从影响化学反应速率的因素看,你的猜想还可能是_______________的影响。
(2)若用实验证明你的猜想,除酸性高锰酸钾溶液、草酸溶液试剂外,还需要选择的试剂最合理的是__________________。
A.硫酸钾 B.硫酸锰 C.氯化锰 D.水