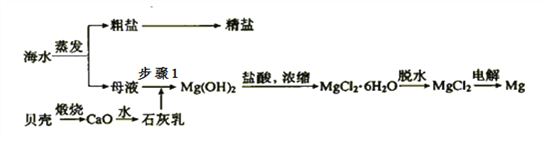
题目内容
【题目】CuCl 广泛应用于化工和印染等行业。某研究性学习小组拟热分解CuCl2·2H2O 制备CuCl,并进行相关探究。
【资料查阅】得知:CuCl常温下是固体,露置于空气中易被氧化为绿色的高价铜盐。CuCl2·2H2O加热分解的情况如右图所示:
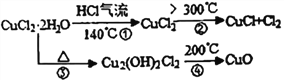
【实验探究】该小组用如图所示装置进行实验(夹持仪器已略)。

根据以上信息请回答下列问题:
(1)装置E的作用是____________________。
(2)实验操作的先后顺序是a→______________________(填操作的编号)
a.检查装置的气密性后加入药品 b.熄灭酒精灯,冷却 c.在“气体入口”处通入干燥HCl d.点燃酒精灯,加热 e.停止通入HCl,然后通入N2
(3)某同学设计的检验该装置气密性的方法是:将装置E上面的倒置漏斗换成导管,在烧杯中加少量水,将导管插入水中,在装置的气体入口处装上橡皮管,并用弹簧夹夹紧,用酒精灯微微加热玻璃管,若导管口有气泡冒出,撤去热源后,导管中有一段稳定的水柱,则装置气密性良好。你认为该同学的设计是否合理________(填“是”或“否”)。
(4)在实验过程中观察到C中纸条的颜色不变,D中纸条的先变红后褪色,其褪色的原因可能是________(填序号)。
A.氯化氢水溶液有漂白性 B.氯气的水溶液有漂白性
C.氯化氢气体有漂白性 D.干燥的氯气有漂白性
(5)停止通入HCl后,通入N2的目的是____________________。
(6)上述CuCl2·2H2O加热分解过程中④中发生反应的化学反应方程式是________________________。
(7)配平工业制备CuCl时发生反应的离子方程式:
Cu2++Cl-+SO32-+H2O→CuCl+H++SO42-,请依次写出配平后的化学计量数__________。
(8)准确称取所制备的氯化亚铜药品mg,将其置于足量的FeCl3溶液中,待样品完全溶解后,加入适量稀硫酸,用a mol/L的K2Cr2O7溶液滴定到终点,消耗K2Cr2O7溶液b mL,反应中Cr2O72-被还原为Cr3+,样品中CuCl的质量分数为__________。若滴定结束时,滴定管中有气泡,则样品中CuCl 的质量分数_________(填“偏大”或“偏小”)。
【答案】 吸收生成的氯气、氯化氢等尾气,并作为防倒吸装置 cdbe 是 B 防止空气进入试管,把氯化亚铜氧化;排尽HCl等气体,使其被NaOH溶液充分吸收 Cu2(OH)2Cl2![]() 2CuO+2HCl↑ 2,2,1, 1,2,2,1
2CuO+2HCl↑ 2,2,1, 1,2,2,1 ![]() ×100% 偏小
×100% 偏小
【解析】试题分析:由题中信息可知,CuCl2·2H2O在HCl气流中受热分解可以生成CuCl和Cl2,由装置出来的气体经浓硫酸干燥后通入C装置,C中干燥的纸条无明显变化,再通过D,D中的潮湿的纸条先变红后褪色,E装置是尾气处理装置,同时可以防止倒吸。
(1)装置E的作用是吸收生成的氯气、氯化氢等尾气,并作为防倒吸装置。
(2)实验操作的先后顺序依次是检查装置的气密性后加入药品;在“气体入口”处通入干燥HCl;点燃酒精灯,加热;熄灭酒精灯,冷却;停止通入HCl,然后通入N2。故填cdbe 。
(3)某同学设计的检验该装置气密性的方法是:将装置E上面的倒置漏斗换成导管,在烧杯中加少量水,将导管插入水中,在装置的气体入口处装上橡皮管,并用弹簧夹夹紧,用酒精灯微微加热玻璃管,若导管口有气泡冒出,撤去热源后,导管中有一段稳定的水柱,则装置气密性良好。该同学的设计是合理的。
(4)在实验过程中观察到C中纸条的颜色不变,D中纸条的先变红后褪色,其褪色的原因是氯气与水反应生成盐酸和次氯酸,次氯酸有漂白性,故氯气的水溶液有漂白性,选B。
(5)停止通入HCl后,通入N2的目的是:防止空气进入试管把氯化亚铜氧化;排尽HCl等气体,使其被NaOH溶液充分吸收。
(6)上述CuCl2·2H2O加热分解过程中④中发生反应的化学反应方程式是Cu2(OH)2Cl2![]() 2CuO+2HCl↑。
2CuO+2HCl↑。
(7)工业制备CuCl时发生反应的离子方程式经配平后得到2Cu2++2Cl-+SO32-+H2O=2CuCl+2H++SO42-。
(8)准确称取所制备的氯化亚铜药品mg,将其置于足量的FeCl3溶液中,可以发生CuCl+Fe3+=Cu2++Cl-+ Fe2+,待样品完全溶解后,加入适量稀硫酸,用a mol/L的K2Cr2O7溶液滴定到终点,消耗K2Cr2O7溶液b mL,反应中Cr2O72-被还原为Cr3+,由电子转移守恒可以得到关系式6CuCl~ 6Fe2+~ Cr2O72-,则n(CuCl)=![]() n(K2Cr2O7)=
n(K2Cr2O7)=![]() ,因此,样品中CuCl的质量分数为
,因此,样品中CuCl的质量分数为![]() 100%。若滴定结束时,滴定管中有气泡,则消耗K2Cr2O7溶液的体积读数偏小,导致测定结果(样品中CuCl 的质量分数)偏小。
100%。若滴定结束时,滴定管中有气泡,则消耗K2Cr2O7溶液的体积读数偏小,导致测定结果(样品中CuCl 的质量分数)偏小。

 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案【题目】除去下列物质中混有的杂质,选择试剂及操作都正确的一项是( )
选项 | 物质 | 杂质 | 选择试剂 | 实验操作 |
A | Al2O3 | SiO2 | NaOH溶液 | 过滤 |
B | FeCl2 | FeCl3 | Fe粉 | 过滤 |
C | CO2 | SO2 | 澄清石灰水 | 洗气 |
D | I2 | NaCl | 酒精 | 萃取、分液 |
A.A
B.B
C.C
D.D