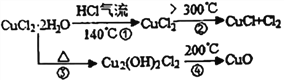题目内容
【题目】大气污染物主要成分是SO2、NO2、NO、CO及可吸入颗粒等,主要来自于燃煤、机动车尾气和工业废气,会导致雾霾、酸雨等。
(1)大气污染物成分中属于酸性氧化物的是_______________________(填化学式)。
(2)工业上可以用NaOH溶液或氨水吸收过量的SO2,分别生成NaHSO3、NH4HSO3。已知H2SO3是二元弱酸,写出反应的离子方程式:
①NaOH溶液吸收过量的SO2:_____________________________________________。
②氨水吸收过量的SO2:___________________________________________________。
(3)汽车的三元催化转化器中,在催化剂作用下NO和CO转化为无毒气体,反应的化学方程式是: 2CO+2NO ![]() 2CO2+N2
2CO2+N2
①该反应中,氧化剂是____________(填化学式),氧化产物是______________(填化学式)。
②当生成2mol N2时,转移电子的物质的量是___________________________。
(4)NH3催化还原氮氧化物(SCR)技术是目前应用最广泛的烟气氮氧化物脱除技术,生成的产物都无毒。NH3还原NO2时,还原剂和氧化剂的物质的量之比是________________。
(5)以NaClO溶液作为吸收剂进行一体化“脱硫”、“脱硝”。控制溶液的pH=5.5,将烟气中的SO2转化为SO42―。已知0.1mol/L 100mLNaClO溶液,可以恰好吸收0.01moL SO2,则反应的离子方程式是____。
(6)SO2通过下列过程既能制得H2SO4又能制得H2。
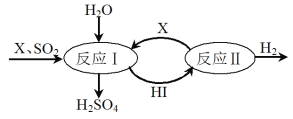
①可循环利用的物质X是_________________(填化学式)。
②制得H2SO4的化学方程式是____________________________________。
③制得H2的化学方程式是___________________________。
【答案】SO2 OH-+SO2==HSO3- NH3·H2O+ SO2==HSO3-+NH4+ NO CO2 8mol 4:3 ClO-+SO2+H2O==SO42-+Cl-+2H+ I2 SO2+I2+2H2O== H2SO4+2HI 2HI==H2+I2
【解析】
本题主要考查常见化学反应方程式的书写以及相关性质判断及计算。
(1)酸性氧化物是指能与水作用生成酸或与碱作用生成盐和水的氧化物(且生成物只能有一种盐和水,不可以有任何其它物质生成);
(2)①②根据题干信息进行书写即可;
(3)①该反应中CO中C的化合价升高2价,NO中N的化合价降低2价;②根据电子得失计算;
(4)由题干信息中“生成的产物都无毒”可知,生成物为N2和H2O,根据氧化还原反应中化合价升降相等或化学方程式计算;
(5)由题干信息计算出化合价升高总数或失电子总数,根据氧化还原反应中得失电子数相等判断ClO-与SO2的系数比,再根据该反应的化学环境为酸性配平化学方程式;
(5)①根据反应II中元素守恒以及化合价升降判断X;
②反应I为X与SO2和H2O反应生成HI和H2SO4,根据氧化还原反应配平原则配平;
③反应II为HI分解为X和H2。
(1)上述气体中,属于酸性氧化物的是SO2;
(2)①根据题干信息可知,NaOH与过量SO2反应生成NaHSO3,故其离子反应方程式为:OH-+SO2==HSO3-;
②由题干信息可知,氨水吸收过量的SO2,生成NH4HSO3,其离子反应方程式为:NH3·H2O+ SO2==HSO3-+NH4+;
(3)①该反应中CO中C元素的化合价升高2,NO中N元素的化合价降低2,故氧化剂是NO;氧化产物为CO2;
②由该反应化合价升降可知,每生成1molN2,转移电子4mol,故当生成2mol N2时,转移电子的物质的量是8mol;
(4)该反应的化学方程式为:8NH3+6NO2![]() 7N2+6H2O,该反应中氧化剂为NO2,还原剂为NH3,根据方程式可知,还原剂与氧化剂之比为4:3;
7N2+6H2O,该反应中氧化剂为NO2,还原剂为NH3,根据方程式可知,还原剂与氧化剂之比为4:3;
(5)该反应过程中,0.01molSO2被氧化失去电子0.02mol,0.01molNaClO被还原,根据得失电子数相等可知,还原产物为Cl-,故该离子方程式为:ClO-+SO2+H2O==SO42-+Cl-+2H+;
(6)①反应II为HI的分解反应:2HI===H2![]() +I2,故X为I2;
+I2,故X为I2;
②由上述分析可知,反应I为I2与SO2和H2O反应生成HI和H2SO4,其化学方程式为SO2+I2+2H2O== H2SO4+2HI;
③反应II的化学方程式为2HI===H2![]() +I2。
+I2。

 一本好题口算题卡系列答案
一本好题口算题卡系列答案【题目】某小组实验探究葡萄糖、二氧化硫分别与新制氢氧化铜的反应。
实验I新制Cu(OH)2与葡萄糖反应
(1)将1.5mL1.0mol/LCuSO4溶液滴入5mLl.0mol/LNaOH溶液中制得Cu(OH)2悬浊液。相关反应的离子方程式为___________。
(2)在制得的Cu(OH)2悬浊液中加入稍过量葡萄糖溶液,加热煮沸,产生红色沉淀。
①该实验现象说明_______________;
②该原理可用于检测糖尿病患者血液中的______含量。
实验II新制Cu(OH)2与二氧化硫反应
按上述方法重新制取氢氧化铜悬浊液,通入足量二氧化硫,先产生红色沉淀,然后红色沉淀逐渐变为紫红色固体,最终溶液呈无色。
(1)探究红色沉淀转变为紫红色的原因。
将实验I产生的红色沉淀过滤、洗涤,洗涤方法是_____。
将所得固体分成两等份于试管中并加入少量蒸馏水进行对比实验。
实验装置图 |
|
|
操作及现象 | 红色固体很快转变为紫红色固体,溶液呈蓝色。 | 开始红色固体缓慢变为紫红色固体,溶液呈蓝色。试管内紫红色固体逐渐增多,最后溶液变无色。 |
解释及结论 | ①该反应的离子方程式 _________________。 | ②开始时红色固体颜色变化缓慢的原因是_________。 ③所得无色溶液中主要阴离子为___________________。 |
(2)通过上述探究,写出新制氢氧化铜与过量SO2反应的总化学方程式______________。
反思:将表中SO2换为NO2是否能观察到相同现象?回答并解释:__________。