题目内容
6. 25℃时,将氨水与氯化铵溶液混合得到 c(NH3•H2O)+c(NH4+)=0.1mol•L-1的混合溶液.溶液中c(NH3•H2O)、c(NH4+)与pH的关系如图所示.下列有关离子浓度关系叙述一定正确的是( )
25℃时,将氨水与氯化铵溶液混合得到 c(NH3•H2O)+c(NH4+)=0.1mol•L-1的混合溶液.溶液中c(NH3•H2O)、c(NH4+)与pH的关系如图所示.下列有关离子浓度关系叙述一定正确的是( )| A. | W点表示溶液中:c(NH4+)+c(H+)=c(OH-) | |
| B. | pH=10.5溶液中:c(Cl-)+c(OH-)+c(NH3•H2O)<0.1 mol•L-1 | |
| C. | pH=9.5溶液中:c(NH3•H2O)>c(NH4+)>c(OH-)>c(H+) | |
| D. | 向W点所表示1L溶液中加入0.05molNaOH固体(忽略溶液体积变化):c(Cl-)>c(Na+)>c(OH-)>c(NH4+)>c(H+) |
分析 将氨水与氯化铵溶液混合得到 c(NH3•H2O)+c(NH4+)=0.1mol•L-1的混合溶液,当溶液中只有NH4+时,NH4+水解使溶液呈酸性,随着c(NH3•H2O)的增大,溶液碱性增强,根据图示,当pH=9.25时,c(NH3•H2O)=c(NH4+),因此判断当pH<9.25时,c(NH3•H2O)<c(NH4+),当pH>9.25时,c(NH3•H2O)>c(NH4+),因此判断随着pH增大浓度增大的是c(NH3•H2O)、减小的是 c(NH4+),
A.任何电解质溶液中都存在电荷守恒,根据电荷守恒判断;
B.该混合溶液中,无论pH如何变化都存在c(Cl-)+c(OH-)=c(NH4+)+c(H+),则c(Cl-)+c(OH-)+c(NH3•H2O)=c(NH4+)+c(H+)+c(NH3•H2O);
C.pH=9.5溶液中,pH>7,溶液呈碱性,则c(OH-)>c(H+);根据分析可知,当pH>9.25时,c(NH3•H2O)>c(NH4+);
D.任何电解质溶液中都存在物料守恒,根据物料守恒判断.
解答 解:将氨水与氯化铵溶液混合得到 c(NH3•H2O)+c(NH4+)=0.1mol•L-1的混合溶液,当溶液中只有NH4+时,NH4+水解使溶液呈酸性,随着c(NH3•H2O)的增大,溶液碱性增强,根据图示,当pH=9.25时,c(NH3•H2O)=c(NH4+),因此判断当pH<9.25时,c(NH3•H2O)<c(NH4+),当pH>9.25时,c(NH3•H2O)>c(NH4+),因此判断随着pH增大浓度增大的是c(NH3•H2O)、减小的是 c(NH4+),
A.任何电解质溶液中都存在电荷守恒,根据电荷守恒得c(Cl-)+c(OH-)=c(NH4+)+c(H+),所以c(NH4+)+c(H+)>c(OH-),故A错误;
B.该混合溶液中,无论pH如何变化都存在c(Cl-)+c(OH-)=c(NH4+)+c(H+),则c(Cl-)+c(OH-)+c(NH3•H2O)=c(NH4+)+c(H+)+c(NH3•H2O)=0.1mol/L+c(H+)>0.1mol/L,故B错误;
C.pH=9.5溶液中,pH>7,溶液呈碱性,则c(OH-)>c(H+),根据分析可知,当pH>9.25时,c(NH3•H2O)>c(NH4+),所以粒子浓度大小顺序是c(NH3•H2O)>c(NH4+)>c(OH-)>c(H+),故C正确;
D.任何电解质溶液中都存在物料守恒,根据物料守恒得c(Cl-)=c(Na+),故D错误;
故选C.
点评 本题考查离子浓度大小比较,存在考查学生图象分析及判断能力,明确溶液中的溶质及其性质是解本题关键,注意利用守恒方法解答,易错选项是B,注意利用电荷守恒进行代换,题目难度中等.

 同步练习河南大学出版社系列答案
同步练习河南大学出版社系列答案 同步练习西南师范大学出版社系列答案
同步练习西南师范大学出版社系列答案 补充习题江苏系列答案
补充习题江苏系列答案 学练快车道口算心算速算天天练系列答案
学练快车道口算心算速算天天练系列答案 往密闭容器中通入一定量N2O4,发生反应N2O4(g)?2NO2(g),随温度升高,气体颜色变深.如图表示该反应平衡时有关物理量Y随某条件X(其他条件不变)变化的规律.X、Y分别是( )
往密闭容器中通入一定量N2O4,发生反应N2O4(g)?2NO2(g),随温度升高,气体颜色变深.如图表示该反应平衡时有关物理量Y随某条件X(其他条件不变)变化的规律.X、Y分别是( )| A. | 温度T,逆反应速率υ逆 | B. | 温度T,气体的密度ρ | ||
| C. | 压强P,平衡常数K | D. | 压强P,N2O4转化率α |
| A. | X:3s23p1 Y:3s23p5 | B. | X:2s22p3 Y:2s22p4 | ||
| C. | X:3s23p1 Y:2s22p5 | D. | X:2s22p3 Y:1s1 |
| A. | 分子式为C10H12O2的有机物,①苯环上有两个取代基,②能与NaHCO3反应生成气体,满足以上2个条件的该有机物的同分异构体有15种 | |
| B. | 对苯二甲酸( 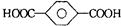 )与乙二醇(HOCH2CH2OH)能通过加聚反应制取聚酯纤维 ( )与乙二醇(HOCH2CH2OH)能通过加聚反应制取聚酯纤维 (  ) ) | |
| C. | 分子式为C5H12O的醇,能在铜催化下被O2氧化为醛的同分异构体有5种 | |
| D. | 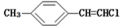 分子中的所有原子有可能共平面 分子中的所有原子有可能共平面 |

| A. | 从KI和I2的固体混合物中回收I2,可使用如图甲所示实验装置 | |
| B. | 分离Na2CO3溶液和CH3COOC2H5,可使用如图乙所示实验装置 | |
| C. | 用图丙所示仪器配制0.150mol/LNaOH溶液 | |
| D. | 如图丁所示可用于实验室制氨气并收集干燥的氨气 |
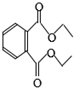
| A. | 该物质能使溴的四氯化碳溶液褪色 | |
| B. | 其分子式为C12H15O4 | |
| C. | 该物质完全水解能生成三种产物 | |
| D. | 1mol该物质与足量NaOH溶液反应能消耗2molNaOH |
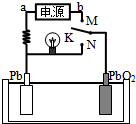 如图是铅蓄电池充、放电时的工作示意图,电解质是H2SO4溶液.已知放电时电池反应为:Pb+PbO2+4H++2SO42-═2PbSO4+2H2O.下列有关说法正确的是( )
如图是铅蓄电池充、放电时的工作示意图,电解质是H2SO4溶液.已知放电时电池反应为:Pb+PbO2+4H++2SO42-═2PbSO4+2H2O.下列有关说法正确的是( )| A. | K与N相接时,能量由化学能转化为电能 | |
| B. | K与N相接时,H+向负极区迁移 | |
| C. | K与M连接时,所用电源的a极为负极 | |
| D. | K与M相接时,阳极附近的pH逐渐增大 |

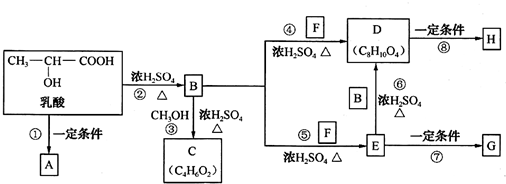
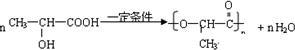 .
.