题目内容
8.常温下,下列有关叙述正确的是( )| A. | 0.1 mol/L NaHCO3溶液中:c(Na+)>c(HCO3-)>c(CO32-)>c(H2CO3) | |
| B. | Na2CO3溶液中,2c(Na+)=c(CO32-)+c(HCO3-)+c(H2CO3) | |
| C. | pH均为11的下列溶液:①NaOH ②KHCO3③CH3COONa,其浓度大小:①>③>② | |
| D. | 常温下NaB溶液的pH=8,则c(Na+)-c(B-)=9.9×10-7 mol/L |
分析 A.碳酸氢钠溶液呈碱性,说明碳酸氢根离子的电离程度小于水解程度,所以c(H2CO3)>c(CO32-);
B.根据物料守恒,分析解答;
C.等浓度时强碱的pH最大,强碱弱酸盐中对应的酸性越强,水解程度越小,所以pH相同时,其浓度大小:①<③<②;
D.根据NaB溶液中的电荷守恒计算.
解答 解:A.碳酸氢钠溶液呈碱性,说明碳酸氢根离子的电离程度小于水解程度,所以c(H2CO3)>c(CO32-),故A错误;
B.根据物料守恒,c(Na+)=2c(CO32-)+2c(HCO3-)+2c(H2CO3),故B错误;
C.等浓度时强碱的pH最大,强碱弱酸盐中对应的酸性越强,水解程度越小,所以pH相同时,其浓度大小:①<③<②,故C错误;
D.根据NaB溶液的pH=8可知,在溶液中存在c(Na+)+c(H+)=c(OH-)+c(B-),c(Na+)-c(B-)=c(OH-)-c(H+)=10-6moL/L-10-8mol/L=9.9×10-7mol/L,故D正确;
故选D.
点评 本题考查离子浓度大小比较,题目难度中等,试题涉及pH的简单计算、离子浓度大小比较以及酸碱混合的PH的计算的等问题,本题易错点为B项,注意考虑问题的角度.

练习册系列答案
相关题目
3.现有CuO和Fe2O3组成的混合物a g,向其中加入2mol•L-1的硫酸溶液100mL,恰好完全反应.若将a g该混合物在足量H2中加热,使其充分反应,冷却后剩余固体质量为( )
| A. | 1.6a g | B. | (a-3.2)g | C. | (a-1.6)g | D. | 1.6 g |
3.用NA代表阿伏伽德罗常数,下列说法正确的是( )
| A. | 14gC2H4和C4H8NA的混合气体中所含的共价键数为3NA | |
| B. | 化学反应中每生成1molO2转移电子数为4NA | |
| C. | 12g413C含有的碳原子数是NA | |
| D. | 0.1molNa2O2所含阴离子数是0.2NA |
13.下列说法不正确的是( )
| A. | 向沸水中滴加饱和氯化铁溶液,可以制备氢氧化铁胶体,有净水的功能 | |
| B. | 容量瓶、滴定管使用前均需要检漏,并需要润洗以减小实验误差 | |
| C. | 甲烷中混有的少量乙烯可以通过溴水洗涤净化 | |
| D. | 分离乙酸乙酯和乙酸混合液时,先加入一定量的氢氧化钠溶液,生成乙酸钠后进行蒸馏,然后在乙酸钠溶液中加入足量的硫酸再蒸馏可得乙酸 |
20.化学在工农业生产和日常生活中都有着重要的应用.下列叙述不正确的是( )
| A. | 长期使用(NH4)2SO4化肥会使土壤酸化,而过度使用尿素[CO(NH2)2]会使土壤碱化 | |
| B. | 锅炉水垢中含有的CaSO4,可先用Na2CO3溶液处理,后用酸除去 | |
| C. | 铝合金的大量使用归功于人们能用焦炭等还原剂从氧化铝中获取铝单质 | |
| D. | “酸可以除锈”、“热的纯碱溶液去油污”,都发生了化学变化 |
17. 往密闭容器中通入一定量N2O4,发生反应N2O4(g)?2NO2(g),随温度升高,气体颜色变深.如图表示该反应平衡时有关物理量Y随某条件X(其他条件不变)变化的规律.X、Y分别是( )
往密闭容器中通入一定量N2O4,发生反应N2O4(g)?2NO2(g),随温度升高,气体颜色变深.如图表示该反应平衡时有关物理量Y随某条件X(其他条件不变)变化的规律.X、Y分别是( )
 往密闭容器中通入一定量N2O4,发生反应N2O4(g)?2NO2(g),随温度升高,气体颜色变深.如图表示该反应平衡时有关物理量Y随某条件X(其他条件不变)变化的规律.X、Y分别是( )
往密闭容器中通入一定量N2O4,发生反应N2O4(g)?2NO2(g),随温度升高,气体颜色变深.如图表示该反应平衡时有关物理量Y随某条件X(其他条件不变)变化的规律.X、Y分别是( )| A. | 温度T,逆反应速率υ逆 | B. | 温度T,气体的密度ρ | ||
| C. | 压强P,平衡常数K | D. | 压强P,N2O4转化率α |
18.邻苯二甲酸二乙酯是增塑剂,其结构简式如图,关于该物质的说法中正确的是( )
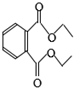

| A. | 该物质能使溴的四氯化碳溶液褪色 | |
| B. | 其分子式为C12H15O4 | |
| C. | 该物质完全水解能生成三种产物 | |
| D. | 1mol该物质与足量NaOH溶液反应能消耗2molNaOH |
 ,该反应的类型为酯化反应;
,该反应的类型为酯化反应; ;
;