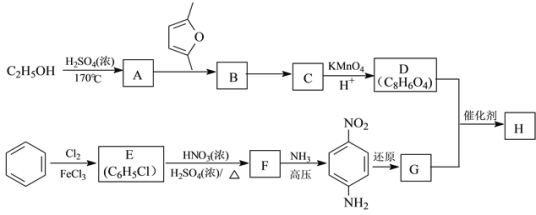
题目内容
【题目】(1)比较给出![]() 能力的相对强弱:
能力的相对强弱:![]() ________
________![]() (填“>”“<”或“=”);用一个化学方程式说明
(填“>”“<”或“=”);用一个化学方程式说明![]() 和
和![]() 结合
结合![]() 能力的相对强弱________。
能力的相对强弱________。
(2)![]() 是离子化合物,各原子均满足8电子稳定结构。写出
是离子化合物,各原子均满足8电子稳定结构。写出![]() 的电子式________。
的电子式________。
(3)在常压下,甲醇的沸点(65℃)比甲醛的沸点(-19℃)高。主要原因是________。
【答案】> ![]()
![]() 甲醇分子间存在氢键
甲醇分子间存在氢键
【解析】
(1)水中羟基氢比乙醇中的羟基氢活泼,水给出氢离子的能力比乙醇要强;反应![]() 可以说明;
可以说明;
(2)Ca核外电子为:2、8、8、2,失去两个电子为Ca2+;C最外层4个电子,两个碳原子共用3电子对,一个碳周围就有7个电子,得到2电子达稳定结构,所以![]() 的电子式为
的电子式为![]() ;
;
(3)甲醇中含有羟基,可以形成分子间氢键,而甲醛是醛基不能形成氢键,只有分子间作用力,氢键的作用力大于分子间作用力,因此,需要更多的能量去破坏氢键使甲醇沸腾,故答案为:甲醇分子间存在氢键。

 新课标快乐提优暑假作业陕西旅游出版社系列答案
新课标快乐提优暑假作业陕西旅游出版社系列答案 暑假衔接培优教材浙江工商大学出版社系列答案
暑假衔接培优教材浙江工商大学出版社系列答案 欣语文化快乐暑假沈阳出版社系列答案
欣语文化快乐暑假沈阳出版社系列答案【题目】高铁酸钠(Na2FeO4)是具有紫色光泽的粉末,是一种高效绿色强氧化剂,碱性条件下稳定,可用于废水和生活用水的处理。实验室以石墨和铁钉为电极,以不同浓度的NaOH溶液为电解质溶液,控制一定电压电解制备高铁酸钠,电解装置和现象如下:
c(NaOH) | 阴极现象 | 阳极现象 |
1 mol·L-1 | 产生无色气体 | 产生无色气体,10min内溶液颜色无明显变化 |
10 mol·L-1 | 产生大量无色气体 | 产生大量无色气体,3min后溶液变为浅紫红色,随后逐渐加深 |
15 mol·L-1 | 产生大量无色气体 | 产生大量无色气体,1min后溶液变为浅紫红色,随后逐渐加深 |
下列说法不正确的是

A. a为铁钉,b为石墨
B. 阴极主要发生反应:2H2O + 2e-=== H2↑+ 2OH-
C. 高浓度的NaOH溶液,有利于发生Fe-6e-+ 8OH-=== FeO42-+ 4H2O
D. 制备Na2FeO4时,若用饱和NaCl溶液,可有效避免阳极产生气体
【题目】实验室需要配制NaOH溶液和硫酸溶液。
Ⅰ、配制100mL 1.0mol·L-1 NaOH溶液

(1)如图所示的仪器中E的名称为___,配制溶液肯定不需要的仪器是___(填序号),还需增加的玻璃仪器有___(填仪器名称)。
(2)在配制NaOH溶液时
①根据计算用托盘天平称取NaOH的质量为___g。
②下列操作对所配溶液浓度的影响是(填“偏高”“偏低”“无影响”)。
操作 | 浓度影响 |
用天平(使用游码)称量时,被称量物与砝码的位置放颠倒了 | ___ |
没有洗涤烧杯和玻璃棒 | ___ |
定容时,仰视读数 | ___ |
容器E未干燥,残余少量水 | ___ |
Ⅱ、配制100mL 0.5mol·L-1 硫酸溶液
用质量分数为98%,密度为1.84g·cm-3的浓硫酸来配制该溶液,该浓硫酸物质的量浓度为___mol·L-1,所需浓硫酸的体积为___mL (计算结果保留一位小数)。
【题目】实验室用少量的溴和足量的乙醇制备1,2一二溴乙烷的装置如图所示:
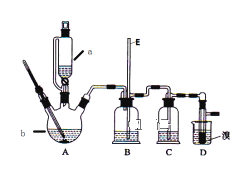
有关数据列表如下:
乙醇 | 1.2二溴乙烷 | 乙醚 | |
状态 | 无色液体 | 无色液体 | 无色液体 |
密度/g/cm﹣3 | 0.79 | 2.2 | 0.71 |
沸点/℃ | 78.5 | 132 | 34.6 |
熔点/℃ | ﹣130 | 9 | ﹣116 |
请按要求回答下列问题:
(1)写出A装置中的化学反应方程式_____;
(2)装置C中盛有氢氧化钠溶液,其作用是_____
(3)在此制备实验中,要尽可能迅速地把反应温度提高到170℃左右,其最主要目的是_____
(4)判断该制备反应已经结束的最简单方法是_____;
(5)若产物中有少量未反应的Br2,最好用_____洗涤除去;(填正确选项前的字母)
a 水 b 亚硫酸氢钠 c 碘化钠溶液 d 乙醇
(6)反应过程中应用冷水冷却装置D,其主要目的是_____;但又不能过度冷却(如用冰水),其原因是_____.