题目内容
下列说法正确的是
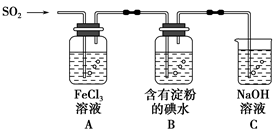
| A.二氧化硫具有漂白性,所以可以使溴水褪色 |
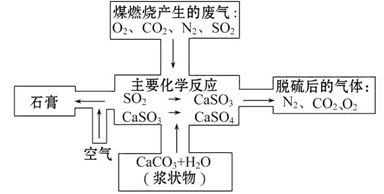
| B.硫在少量氧气中燃烧生成二氧化硫,在过量氧气中燃烧生成三氧化硫 |
| C.雷雨天氮元素可以进行下列转化:N2→NO→NO2→HNO3 |
| D.氮气的化学性质非常稳定,不支持任何物质的燃烧 |
C
试题分析:A、二氧化硫具有漂白性,但不能漂白溴水。由于二氧化硫具有还原性,而溴水具有氧化性,因此能使溴水褪色,发生的是氧化还原反应,A不正确;B、硫在氧气中燃烧不论是氧气过量与否,均是生成二氧化硫。二氧化硫在催化剂的作用下被氧化生成三氧化硫,B不正确;C、氮气与氧气在放电的条件下可以化合生成NO,NO极易被氧化生成NO2,NO2溶于水生成硝酸和NO,所以雷雨天氮元素可以进行下列转化:N2→NO→NO2→HNO3,C正确;D、氮气的化学性质很稳定,但是镁能在氮气中燃烧生成氮化镁,D不正确,答案选C。

练习册系列答案
相关题目