题目内容
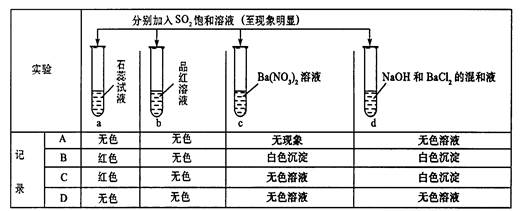
下列实验报告记录的实验现象正确的是( )

B
试题分析:a试管中:SO2通入石蕊溶液中,因SO2不能使酚酞和石蕊褪色。所以应考虑SO2在水中生成H2SO3使得溶液显酸性,石蕊遇酸变红。b试管中:SO2可是品红溶液褪色,所以SO2通入品红变为无色溶液。c试管中:SO2具有还原性,在酸性条件下Ba(NO3)2溶液中的NO3-具有氧化性,可将SO2氧化成SO42-,最终生成BaSO4白色沉淀。d试管中:SO2与NaOH反应会生成Na2SO3和水。而SO32-与Ba2+反应生成BaSO3白色沉淀。2的化学性质:酸性氧化物,漂白性,还原性。

练习册系列答案
相关题目
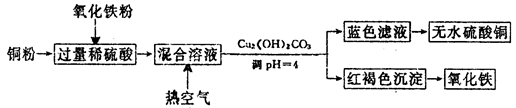
 2CuO,CuO+H2SO4=CuSO4+H2O。
2CuO,CuO+H2SO4=CuSO4+H2O。