题目内容
向CH3COOH 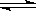 CH3COO-+ H+ 的平衡体系中,加入下列物质能使醋酸的电离程度和溶液的pH都变大的是( )
CH3COO-+ H+ 的平衡体系中,加入下列物质能使醋酸的电离程度和溶液的pH都变大的是( )
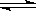 CH3COO-+ H+ 的平衡体系中,加入下列物质能使醋酸的电离程度和溶液的pH都变大的是( )
CH3COO-+ H+ 的平衡体系中,加入下列物质能使醋酸的电离程度和溶液的pH都变大的是( )| A.NH4Cl固体 | B.CH3COONa | C.NH3·H2O | D.Zn粉 |
C
略

练习册系列答案
 每日10分钟口算心算速算天天练系列答案
每日10分钟口算心算速算天天练系列答案
相关题目
题目内容
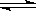 CH3COO-+ H+ 的平衡体系中,加入下列物质能使醋酸的电离程度和溶液的pH都变大的是( )
CH3COO-+ H+ 的平衡体系中,加入下列物质能使醋酸的电离程度和溶液的pH都变大的是( )| A.NH4Cl固体 | B.CH3COONa | C.NH3·H2O | D.Zn粉 |

 每日10分钟口算心算速算天天练系列答案
每日10分钟口算心算速算天天练系列答案