题目内容
【题目】某学习小组通过下列装置探究MnO2与FeCl36H2O能否反应产生Cl2。
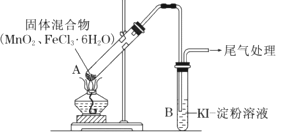
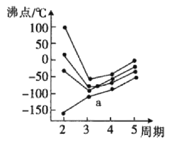
资料:FeCl3是一种共价化合物,熔点306℃,沸点315℃。
ⅰ.实验操作和现象:
操作 | 现象 |
点燃酒精灯,加热 | i.A中部分固体溶解,上方出现白雾 ii.稍后,产生黄色气体,管壁附着黄色液滴 iii.B中溶液变蓝 |
ⅱ.分析现象的成因:
(1)现象i中的白雾是______,用化学方程式和必要的文字说明白雾的形成原因是______。
(2)分析现象ii,该小组探究黄色气体的成分,实验如下:
a.直接加热FeCl3·6H2O,产生白雾和黄色气体。
b.将现象ii和a中的黄色气体通入KSCN溶液,溶液均变红。通过该实验说明现象ii中黄色气体含有______。
(3)除了氯气可使B中溶液变蓝外,该小组还提出其他两种可能的原因:
可能原因①:实验b检出的气体使之变蓝;
反应的离子方程式是______。
可能原因②:______;
反应的离子方程式是______。
(4)为进一步确认黄色气体中是否含有Cl2,小组提出两种方案,均证实了Cl2的存在。
方案1 | 在A、B间增加盛有某种试剂的洗气瓶C | B中溶液变为蓝色 |
方案2 | 将B中KI-淀粉溶液替换为NaBr溶液;检验Fe2+ | B中溶液呈浅橙红色;未检出Fe2+ |
①方案1的C中盛放的试剂是______,从化学平衡原理的角度加以解释______。
②方案2中检验Fe2+的最佳试剂是______,若存在Fe2+,则现象是______。
③综合方案1、2的现象,说明方案2中选择NaBr溶液的依据是______。
(5)将A中产物分离得到Fe2O3和MnCl2,A中产生Cl2的化学方程式是______。
【答案】盐酸小液滴(或盐酸酸雾) FeCl3+3H2O![]() Fe(OH)3+3HCl加热时,水解反应产生HCl,HCl挥发出来遇水蒸气形成白雾 FeCl3 2Fe3++2I-=I2+2Fe2+ 在酸性条件下,装置中的空气使之变蓝 4H++4I-+O2=I2+2H2O 饱和食盐水 Cl2+HO
Fe(OH)3+3HCl加热时,水解反应产生HCl,HCl挥发出来遇水蒸气形成白雾 FeCl3 2Fe3++2I-=I2+2Fe2+ 在酸性条件下,装置中的空气使之变蓝 4H++4I-+O2=I2+2H2O 饱和食盐水 Cl2+HO![]() HCl+HClO,饱和食盐水可以吸收HCl和FeCl3且c(Cl-)较大,抑制上述反应 K3[Fe(CN)6](或铁氰化钾) 蓝色沉淀 氧化性强弱顺序Cl2>Br2>Fe3+ 2FeCl3·6H2O+MnO2
HCl+HClO,饱和食盐水可以吸收HCl和FeCl3且c(Cl-)较大,抑制上述反应 K3[Fe(CN)6](或铁氰化钾) 蓝色沉淀 氧化性强弱顺序Cl2>Br2>Fe3+ 2FeCl3·6H2O+MnO2![]() Fe2O3+MnCl2+Cl2↑+2HCl↑+11H2O
Fe2O3+MnCl2+Cl2↑+2HCl↑+11H2O
【解析】
(1)FeCl3·6H2O 受热失去结晶水FeCl3·6H2O![]() FeCl3+6H2O,同时水解FeCl3+3H2O
FeCl3+6H2O,同时水解FeCl3+3H2O![]() Fe(OH)3+3HCl,生成HCl气体,HCl和H2O结合形成盐酸小液滴,而形成白雾;
Fe(OH)3+3HCl,生成HCl气体,HCl和H2O结合形成盐酸小液滴,而形成白雾;
故答案为:HCl小液滴;FeCl3+3H2O![]() Fe(OH)3+3HCl加热时,水解反应产生HCl,HCl挥发出来遇水蒸气形成白雾;
Fe(OH)3+3HCl加热时,水解反应产生HCl,HCl挥发出来遇水蒸气形成白雾;
(2)FeCl3溶液中滴入KSCN溶液,发生络合反应,Fe3++3SCN-=Fe(SCN)3,生成血红色的硫氰化铁,用KSCN 溶液检验现象ii 和A 中的黄色气体,溶液均变红,说明含有FeCl3,
故答案为:FeCl3;
(3)除了氯气可使B中溶液变蓝外,该小组还提出其他两种可能的原因:可能原因①:实验b检出的气体使之变蓝;碘离子具有还原性,氯化铁具有强氧化性,两者反应,碘离子被氧化为碘单质,反应的离子方程式是2Fe3++2I-=I2+2Fe2+。
可能原因②:在酸性条件下,装置中的空气使之变蓝;氧气将碘离子氧化成碘单质,反应的离子方程式是4H++4I-+O2=I2+2H2O。
故答案为:2Fe3++2I-=I2+2Fe2+;在酸性条件下,装置中的空气使之变蓝;4H++4I-+O2=I2+2H2O;
(4)①方案1氯化铁能氧化碘离子,氧气在酸性条件下,能氧化碘离子,所以需除去Cl2中的FeCl3 和O2(H+),若仍能观察到B中溶液仍变为蓝色,则证明原气体中确实存在Cl2,在A、B间增加盛有饱和食盐水的洗气瓶C,从化学平衡原理的角度加以解释:Cl2+HO![]() HCl+HClO,饱和食盐水可以吸收HCl和FeCl3且c(Cl-)较大,抑制上述反应。
HCl+HClO,饱和食盐水可以吸收HCl和FeCl3且c(Cl-)较大,抑制上述反应。
故答案为:饱和食盐水;Cl2+HO![]() HCl+HClO,饱和食盐水可以吸收HCl和FeCl3且c(Cl-)较大,抑制上述反应;
HCl+HClO,饱和食盐水可以吸收HCl和FeCl3且c(Cl-)较大,抑制上述反应;
②方案2若B中观察到浅橙红色,为溴水的颜色,则证明有物质能够将Br-氧化成Br2,铁离子不能氧化溴离子,若未检查到Fe2+,则证明是Cl2氧化的Br-,而不是Fe3+.另外,因为还原剂用的不是I-,可不用考虑O2(H+)的影响问题,即排除Fe3+将Br-氧化成Br2 的可能性;
方案2中检验Fe2+的最佳试剂是K3[Fe(CN)6](或铁氰化钾)若存在Fe2+,则现象是蓝色沉淀。
故答案为:K3[Fe(CN)6](或铁氰化钾);蓝色沉淀;
③综合方案1、2的现象,Br-可以被Cl2氧化成Br2,但不会被Fe3+氧化为Br2,方案2中选择NaBr溶液的依据是氧化性强弱顺序Cl2>Br2>Fe3+。
故答案为:氧化性强弱顺序Cl2>Br2>Fe3+;
(5)将A中产物分离得到Fe2O3和MnCl2,A中MnO2将氯离子氧化产生Cl2的化学方程式是2FeCl3·6H2O+MnO2![]() Fe2O3+MnCl2+Cl2↑+2HCl↑+11H2O。
Fe2O3+MnCl2+Cl2↑+2HCl↑+11H2O。
故答案为:2FeCl3·6H2O+MnO2![]() Fe2O3+MnCl2+Cl2↑+2HCl↑+11H2O。
Fe2O3+MnCl2+Cl2↑+2HCl↑+11H2O。

【题目】精炼铜工业中阳极泥的综合利用具有重要意义。一种从铜阳极泥(主要含有铜、银、金、少量的镍)中分离提取多种金属元素的工艺流程如图:
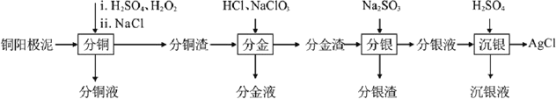
已知:ⅰ分金液中含金离子主要成分为[AuCl4]-;分金渣的主要成分为AgCl;
ⅱ分银液中含银离子主要成分为[Ag(SO3)2]3-,且存在[Ag(SO3)2]3-![]() Ag++2SO32-
Ag++2SO32-
ⅲ“分铜”时各元素的浸出率如下表所示。
Cu | Au | Ag | Ni | |
浸出率/% | 85.7 | 0 | 4.5 | 93.5 |
(1)由表中数据可知,Ni的金属性比Cu____。分铜渣中银元素的存在形式为_________(用化学用语表示)。
(2)“分金”时,单质金发生反应的离子方程式为____。
(3)Na2SO3溶液中含硫微粒物质的量分数与pH的关系如图所示。
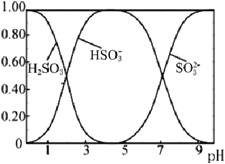
“沉银”时,需加入硫酸调节溶液的pH=4,分析能够析出AgCl的原因为__。调节溶液的pH不能过低,理由为__(用离子方程式表示)。
(4)工业上,用镍为阳极,电解0.1mol/LNiCl2溶液与一定量NH4Cl组成的混合溶液,可得高纯度的球形超细镍粉。当其他条件一定时,NH4Cl的浓度对阴极电流效率及镍的成粉率的影响如图所示:
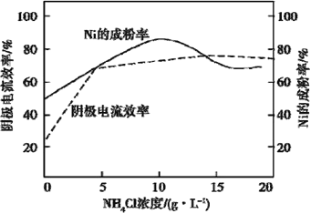
为获得髙纯度的球形超细镍粉,NH4Cl溶液的浓度最好控制为_____g/L,当NH4Cl溶液的浓度大于15g/L时,阴极有无色无味气体生成,导致阴极电流效率降低,该气体为_____。
【题目】下列依据所给条件推出的结论不正确的是( )
选项 | 条件 | 结论 |
A | 在水溶液中或熔融状态下可以导电的化合物称为电解质 | CH3COOH水溶液中存在:CH3COOH |
B | 凡是能给出质子的分子或离子称为酸,凡是能接受质子的分子或离子称为碱 | H2O既是酸又是碱 |
C | Fe3Cl8可以改写为FeCl2·2FeC13 | Fe3I8可以改写为FeI·2FeI3 |
D | HCl在一定条件下能被MnO2氧化为Cl2 | HBr在一定条件下也能被MnO2氧化为Br2 |
A.AB.BC.CD.D