题目内容
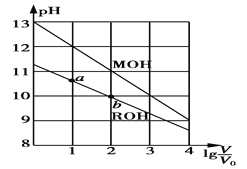
【题目】在图(Ⅰ)所示的装置中,烧杯中盛放的是Ba(OH)2溶液,当从滴定管中逐渐加入某种溶液A时,溶液的导电性的变化趋势如图(Ⅱ)所示。


(1)滴加液体至图(Ⅱ)中曲线最低点时,灯泡可能熄灭,可能的原因是__________________。
(2)试根据离子反应的特点分析,溶液A中含有的溶质可能是(填序号)____________。
①HCl ②H2SO4 ③NaHSO4 ④NaHCO3
(3)已知0.1 mol·L-1NaHSO4溶液中c(H+)=0.1 mol·L-1,请回答下列问题:
①写出NaHSO4在水溶液中的电离方程式___________________________。
②NaHSO4属于________(填“酸”、“碱”或“盐”)。
③向NaHSO4溶液中,逐滴加入Ba(OH)2溶液至中性,请写出发生反应的离子方程式:____________;在以上中性溶液中,继续滴加Ba(OH)2溶液,请写出此步反应的离子方程式:_____________________。
【答案】溶液中离子浓度很小,几乎不导电 ② NaHSO4=Na++H++SO42- 盐 2H++SO42-+Ba2++2OH-=BaSO4↓+2H2O Ba2++SO42-= BaSO4↓
【解析】
根据电解质的电离、离子反应规则分析。
(1) 滴加液体至图(Ⅱ)中曲线最低点时,灯泡可能熄灭,说明随着A的加入溶液导电能力迅速降低,即A必定能与Ba(OH)2发生反应,使溶液中离子浓度变得极小,故答案为:A与溶液中离子浓度很小,几乎不导电;
(2) A必定能与Ba(OH)2发生反应,不仅消耗Ba2+,而且还消耗OH-,故液A中含有的溶质可能是H2SO4,故答案为:②;
(3) ①NaHSO4是强电解质能完全电离,故电离方程式为:NaHSO4=Na++H++SO42-;②
从电离理论来看,NaHSO4是盐,因为它电离出的阳离子是钠离子和氢离子,是强酸性盐,溶液显酸性;③向NaHSO4溶液中,逐滴加入Ba(OH)2溶液至中性,说明NaHSO4中电离出的H+与Ba(OH)2电离的OH-反应,故离子反应方程式为:2H++SO42-+Ba2++2OH-=BaSO4↓+2H2O;在以上中性溶液中,说明硫酸中的H+和氢氧化钡中的OH-都被反应完,OH-OH继续滴加Ba(OH)2溶液,就只有SO42-和Ba2+反应,故离子方程式为:Ba2++SO42-= BaSO4↓ 。

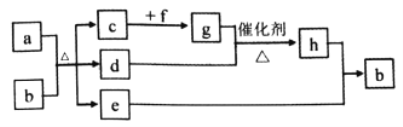
【题目】资料表明:赤热铜能与NO2反应。某小组设计了如下实验装置进行探究,探究固体产物的成分,气体产物是N2还是NO。
已知:酸性KMnO4溶液能氧化NO生成NO3ˉ;
NO和FeSO4溶液反应:NO+FeSO4=[Fe(NO)]SO4(棕色);
Cu2O+2H+=Cu+Cu2++H2O
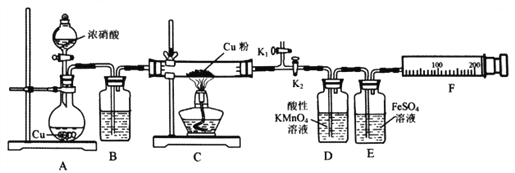
请回答下列问题:
(1)A中反应的化学方程式为________________________。
(2)检查装置气密性,装好药品,然后实验的正确操作顺序是____________
①关闭K1,打开K2 ②打开分液漏斗活塞
③打开K1,关闭K2 ④点燃C处酒精灯
(3)实验过程中,D装置中的现象是____________,能否根据D装置中的现象确认C中有无NO生成? ______,理由是________________________。
(4)E装置的作用是____________。
(5)当铜粉完全反应后,实验小组对反应后的固体成分提出以下猜想:①只有CuO;②只有Cu2O;有同学认为可通过简单的定性实验即可判断猜想①是否成立,其实验方法是_____________________。
(6)实验中E装置自始至终未显棕色,小组最后通过定量实验得到如下数据。
C装置质量 | F装置气体的体积(已折算为标准状况) | ||
玻管质量 | Cu质量 | 反应后(玻管+生成物) | |
mg | 1.92g | (m+2.24)g | 112mL |
据此写出实验时实际发生反应的化学方程式________________________。
【题目】某同学用NaHCO3和KHCO3组成的固体混合物进行实验,测得实验数据(盐酸的物质的量浓度相等)如表所示,下列说法不正确的是 ( )
盐酸/mL | 50 | 50 | 50 |
固体混合物质量/g | 9.2 | 15.7 | 27.6 |
标准状况下CO2体积/L | 2.24 | 3.36 | 3.36 |
A. 盐酸的物质的量浓度为3.0 mol·L-1 B. 根据表中数据能计算出混合物中NaHCO3的质量分数
C. 加入9.2g固体混合物时盐酸过量 D. 15.7g固体混合物恰好与盐酸完全反应