题目内容
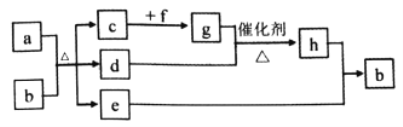
【题目】短周期元素W、X、Y、Z、Q的原子序数依次增大,c、d、e、f、h是由这些元素组成的二元化合物,自然界中硬度最大的单质和a都由X组成,b由W、Y、Q三种元素组成0.05mol/Lb溶液的pH为1,d能使品红溶液褪色,e是液体,f的焰色反应为黄色,上述物质的转化关系如图所示(个别产物略去)。下列说法错误的是( )
A. 二元化合物沸点:e>d>c B. 氢化物的稳定性:Q>Y>X
C. 元素的非金属性:Y>X>W D. 原子半径的大小:Z>Q>Y
【答案】B
【解析】分析:自然界硬度最大的单质为金刚石,X为碳元素a为碳,根据b由W、Y、Q三种元素组成0.05mol/Lb溶液的pH为1,d能使品红溶液褪色,e为液体推出b为硫酸,d为SO2,那么c为CO2,e为H2O,f的焰色反应为黄色又可以和H2O反应,f为Na2O2,进一步推出g为O2,h为SO3,W、X、Y、Z、Q依次为H、C、O、Na、S元素。a、b、c、d、e、f、g、h依次为C、H2SO4、CO2、SO3、H2O、Na2O2、O2、SO3。
A. H2O中有氢键,熔沸点是三种化合物中最高的,CO2比SO3的相对分子质量小,所以熔沸点CO2<SO3,所以三者熔沸点顺序应该是H2O> SO3> CO2,故A正确;B. 元素的非金属性越强对应氢化物的稳定性越稳定,故氢化物的稳定性应该是O的稳定性最好,故B错误;C. H、C、O的非金属性强弱为O>C>H,故C正确;D.同周期随着原子序数增大原子半径依次减小,同主族从上到下半径依次增大,半径大小Na>S>O,故D正确;本题选B。

 轻松暑假总复习系列答案
轻松暑假总复习系列答案【题目】温度为T时,向2.0 L恒容密闭容器中充入2.0 mol X,反应X(g) ![]() Y(g)+Z(g)经一段时间后达到平衡。反应过程中测定的部分数据见下表:
Y(g)+Z(g)经一段时间后达到平衡。反应过程中测定的部分数据见下表:
t/s | 0 | 50 | 150 | 250 | 350 |
n(Y)/mol | 0 | 0.32 | 0.38 | 0.40 | 0.40 |
下列说法不正确的是
A. 反应在前250 s的平均速率为v(Y)=0.000 8 mol·L-1·s-1
B. 保持其他条件不变,升高温度,平衡时c(Y)=0.21 mol·L-1,则反应的ΔH>0
C. 相同温度下,起始时向容器中充入4.0 mol Y、4.0 mol Z,达到平衡时,则此反应的化学平衡常数为1/20
D. 相同温度下,若起始时向容器中充入2.0 mol X、0.40 mol Y和0.80 mol Z,则达到平衡前v(正)>v(逆)


