��Ŀ����
����Ŀ�����ϱ���������ͭ����NO2��Ӧ��ijС�����������ʵ��װ�ý���̽����̽���������ijɷ֣����������N2����NO��
��֪������KMnO4��Һ������NO����NO3����
NO��FeSO4��Һ��Ӧ��NO+FeSO4=[Fe(NO)]SO4(��ɫ)��
Cu2O+2H+=Cu+Cu2++H2O
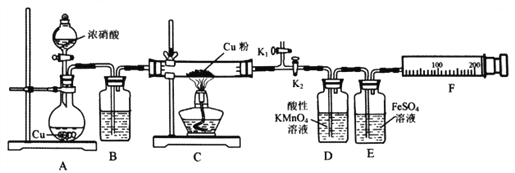
��ش��������⣺
��1��A�з�Ӧ�Ļ�ѧ����ʽΪ________________________��
��2�����װ�������ԣ�װ��ҩƷ��Ȼ��ʵ�����ȷ����˳����____________
���ر�K1����K2 ����Һ©������
����K1���ر�K2 ����ȼC���ƾ���
��3��ʵ������У�Dװ���е�������____________���ܷ����Dװ���е�����ȷ��C������NO����? ______��������________________________��
��4��Eװ�õ�������____________��
��5����ͭ����ȫ��Ӧ��ʵ��С��Է�Ӧ��Ĺ���ɷ�������²��룺��ֻ��CuO����ֻ��Cu2O����ͬѧ��Ϊ��ͨ���Ķ���ʵ�鼴���жϲ������Ƿ��������ʵ�鷽����_____________________��
��6��ʵ����Eװ����ʼ����δ����ɫ��С�����ͨ������ʵ��õ��������ݡ�
Cװ������ | Fװ����������(������Ϊ��״��) | ||
�������� | Cu���� | ��Ӧ��(����+������) | |
mg | 1.92g | (m+2.24)g | 112mL |
�ݴ�д��ʵ��ʱʵ�ʷ�����Ӧ�Ļ�ѧ����ʽ________________________��
���𰸡� Cu+4HNO3(Ũ)=Cu(NO3)2+2NO2��+2H2O �ۢڢ٢� �����ݲ������Ϻ�ɫ��Һ��ɫ��dz(��ɫ) �� NO2��H2O��Ӧ����NO(��NO2��ʹ���Ը��������Һ��ɫҲ����) �����Ƿ���NO�����NO�Ƿ������� ȡC�й������Թ��У�����������ϡ�����ַ�Ӧ����������ȫ�ܽ⣬�����ֻ��CuO 6Cu+2NO2![]() 2CuO+2Cu2O+N2
2CuO+2Cu2O+N2
����������1��A�з���ͭ��Ũ����ķ�Ӧ����ѧ����ʽΪCu+4HNO3(Ũ)=Cu(NO3)2+2NO2��+2H2O
��2�����ȴ�K1���ر�K2����Һ©��������Ӧ��ʼ���У�������NO2��װ���еĿ����Ÿɾ���Ȼ��ر�K1����K2 ����ȼC���ƾ��ƣ���ʱע��۲�D��E�е�����������ȷ˳��Ϊ�ۢڢ٢���
��3����֪������KMnO4��Һ������NO����NO3��������D�г��ֵ�����Ӧ���ǣ������ݲ������Ϻ�ɫ��Һ��ɫ��dz(��ɫ)��NO2��H2O��Ӧ����NO��NO2Ҳ��ʹ���Ը��������Һ��ɫ�����Խ�ƾ��һ������˵�� C����NO���ɣ���Ϊ�������ݲ������Ϻ�ɫ��Һ��ɫ��dz(��ɫ) ������NO2��H2O��Ӧ����NO(��NO2��ʹ���Ը��������Һ��ɫ)��
��4����֪NO��FeSO4��Һ��Ӧ��NO+FeSO4=[Fe(NO)]SO4(��ɫ)������Eװ�ÿ��Լ����Ƿ���NO�����NO�Ƿ������ꡣ
��5�������Ѿ�Cu2O+2H+=Cu+Cu2++H2O����ϡ����Լ����Ƿ���Cu2O������Cu2O���Կ�������Cu���ɣ��ʴ�Ϊ��ȡC�й������Թ��У�����������ϡ�����ַ�Ӧ����������ȫ�ܽ⣬�����ֻ��CuO��
��6��ʵ����Eװ����ʼ����δ����ɫ��˵��û������NO���Dz���Ӧ����N2��Fװ���ռ�������Ϊ������n(N2)=0.112L/22.4L/mol=0.005mol������O������=m+2.24-m-1.92=0.32g����һ�����n(O)=0.32g/16g/mol=0.02mol������n(NO2)=0.01mol�����ʵ����ȵ��ڻ�ѧ�������ȣ����Կ���д����ѧ��Ӧ����ʽΪ6Cu+2NO2![]() 2CuO+2Cu2O+N2��
2CuO+2Cu2O+N2��

 Сѧ��ʱ��ҵȫͨ����ϵ�д�
Сѧ��ʱ��ҵȫͨ����ϵ�д� �����ÿ�ʱѵ��ϵ�д�
�����ÿ�ʱѵ��ϵ�д� ��Ԫȫ��������ϵ�д�
��Ԫȫ��������ϵ�д�����Ŀ���¶�ΪTʱ����2.0 L�����ܱ������г���2.0 mol X����ӦX(g) ![]() Y(g)��Z(g)��һ��ʱ���ﵽƽ�⡣��Ӧ�����вⶨ�IJ������ݼ��±���
Y(g)��Z(g)��һ��ʱ���ﵽƽ�⡣��Ӧ�����вⶨ�IJ������ݼ��±���
t/s | 0 | 50 | 150 | 250 | 350 |
n(Y)/mol | 0 | 0.32 | 0.38 | 0.40 | 0.40 |
����˵������ȷ����
A. ��Ӧ��ǰ250 s��ƽ������Ϊv(Y)��0.000 8 mol��L��1��s��1
B. ���������������䣬�����¶ȣ�ƽ��ʱc(Y)��0.21 mol��L��1����Ӧ����H>0
C. ��ͬ�¶��£���ʼʱ�������г���4.0 mol Y��4.0 mol Z���ﵽƽ��ʱ����˷�Ӧ�Ļ�ѧƽ�ⳣ��Ϊ1/20
D. ��ͬ�¶��£�����ʼʱ�������г���2.0 mol X��0.40 mol Y��0.80 mol Z����ﵽƽ��ǰv(��)>v(��)
����Ŀ�����и������ܴ������棬��������Ӧ�Լ���ᷢ����ѧ�仯���ҷ�����Ӧ�����ӷ���ʽ��д��ȷ����( )
ѡ�� | ���飨ˮ��Һ�� | �����Լ� | ���ӷ���ʽ |
A | H+�� Na���� | Fe�� | Fe+H+=Fe3++H2�� |
B | Na����Cl���� | ������ | 2Na+2H2O=2Na��+2OH-+H2�� |
C | NH4+��H+��CH3COO- | ������ | 6H++Fe2O3=2Fe3++3H2O |
D | Ca2����OH-��Cl�� | ͨ�����CO2 | OH-+CO2= |
A. A B. B C. C D. D
����Ŀ���й�ʮ�Ŵ�ָ�����ӿ�ˮ��Ⱦ���Ρ�ʵʩ�����ͽ��������ۺ�������������Ⱦ�������ǻ�ѧ�������о�����Ҫ���⣬Ҳ�Ǽ�������ˮ��ɽ���ǽ�ɽ��ɽ������Ҫ�ٴ롣��ش��������⣺
��ѧ�о���������ǰӦ����㷺�Ļ�ʯȼ�ϵ���������Ҷ���ݽߣ������Σ������Ч;��֮һ����ʵ��ȼ�Ϻ�ȼ�ղ���֮�������ѭ��(��ͼ����ʾ)��
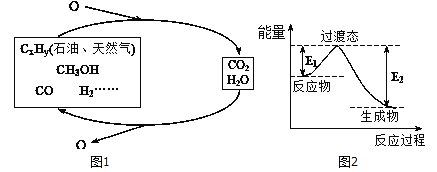
��1��һ�ֳ��õķ�������230�����д��������½�CO2��H2��ת��Ϊ�״�������ˮ������ͼ��������1molCH3OHʱ�������仯ʾ��ͼ����֪�ƻ�1mol��ͬ���ۼ�������(kJ) �ֱ����±���
C-H | C-O | C=O | H-H | H-O |
413.4 | 351 | 745 | 436 | 462.8 |
������ϱ����ݣ���д������CH3OH���Ȼ�ѧ��Ӧ����ʽ��____________________��
����֪E2=189.8kJ��mol-1����E1=_______��
��2������ͬ����CO(g) ��H2O(g) �ֱ�ͨ�뵽���Ϊ2L�ĺ����ܱ������н������·�Ӧ�� CO(g)+H2O(g)![]() CO2(g)+H2(g) �õ����±���ʾ�������ݣ�
CO2(g)+H2(g) �õ����±���ʾ�������ݣ�
ʵ�� | �¶�/�� | ��ʼ�� | �ﵽƽ�� | |||
CO/mol | H2O/mol | H2/mol | COת���� | ����ʱ��/min | ||
1 | 650 | 4 | 2 | 1.6 | 6 | |
2 | 900 | 3 | 2 |
| 3 | |
3 | 900 | |||||
���÷�Ӧ����H_______0 (����<������>��)��
��ʵ��2�����µ�ƽ�ⳣ��K=_______��
��ʵ��3�У�����ʼʱ�������м���CO��H2O��CO2��H 2��1mol�����ʱv��_______v�� (����<����>������=��)��
��3���ϳɼ״�ʱ�����CO2 ��������Na2CO3��Һ�ӹ�ҵ����(��Ҫ��CO2) �в�����ԭ����ͼ��
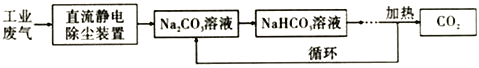
����100mL 0.1mol/L Na2CO3��Һ��ͨ��112mL (�ѻ���Ϊ��״��) CO2��������Һ��û�о����������Իش��������⣺
���ù�ҵ�����������������������װ����������______________________________��ԭ����
�������ӷ���ʽ����Na2CO3��Һ�ʼ��Ե�ԭ��_____________________��
����Ӧ��������Һ�еĸ�����Ũ���ɴ�С��˳����______________________________��



