题目内容
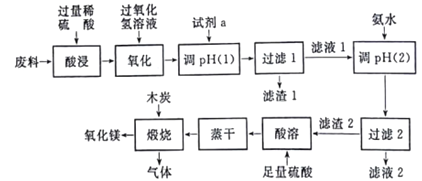
【题目】以黄铁矿为原料制备硫酸会产生大量的废渣,合理利用废渣可以减少环境污染,变废为宝。工业上,可利用废渣(含Fe2+、Fe3+的硫酸盐及少量 CaO和MgO)制备高档颜料铁红(Fe2O3) 和回收(NH4)2SO4,具体生产流程如下。
已知:铵黄铁矾的化学式为(NH4)2Fe6(SO4)4(OH)12。
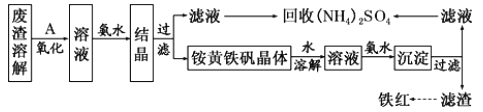
(1)在废渣溶解操作时,应选用________溶解(填字母)。
A.氨水 B.氢氧化钠溶液 C.盐酸 D.硫酸
(2)为了提高废渣溶解时的浸取效率,可采用的措施有哪些?___________________(写出一点即可)。
(3)物质A 是一种氧化剂,工业上一般选用空气,其理由是___________。氧化过程中发生反应的离子方程式为_________________。
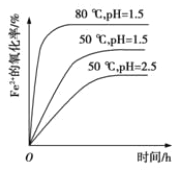
(4)根据下图有关数据,你认为工业上氧化操作时应控制的最佳温度和pH是:______。
(5) 铵黄铁矾中 可能混有的 杂质有 Fe(OH)3、____________。 铵黄铁矾与氨水反应的离子方程式为______________。
【答案】 D 将废渣粉碎、加热、搅拌等 原料易得,成本低, 不产生污染,不引入杂质 4Fe2++O2+4H+===4Fe3++2H2O 80℃ ,pH=1.5 Ca(OH)2、Mg(OH)2、CaSO4 Fe3++3NH3H2O=Fe(OH)3↓+3NH4+
【解析】废渣(含Fe2+、Fe3+的硫酸盐及少量CaO和MgO),将废渣溶解,溶解时加入的物质能溶解废渣但不能引进杂质;然后向溶液中加入A,A具有氧化性,能氧化亚铁离子但不能引进新的杂质且原料易得、成本低,应为空气中的氧气,然后向溶液中加入氨水,溶液中硫酸铁和氨水反应生成铵黄铁矾,同时溶液中镁离子、钙离子形成氢氧化钙、氢氧化镁、硫酸钙等会结晶析出,采用过滤方法分离得到铵黄铁矾和滤液;将滤液蒸发浓缩回收硫酸铵;
将铵黄铁矾溶于水得到溶液,然后向溶液中加入氨水,得到氢氧化亚铁沉淀,然后过滤得到滤渣,将滤渣加热得到铁红,(1)溶解废渣的溶剂能溶解废渣且不能引进新的杂质;(2)提高废渣的浸取率可以粉粹、搅拌、升温等措施;(3)A是氧化剂,具有氧化性,能氧化亚铁离子,但不能引进新的杂质且原料易得、成本低;亚铁离子在酸性溶液中被氧化为铁离子;
(4)依据图象分析,亚铁离子的氧化率最高是溶液温度为80℃,pH为1.5;(5)向溶液中加入氨水,溶液中硫酸铁和氨水反应生成铵黄铁矾,同时溶液中镁离子、钙离子形成氢氧化钙、氢氧化镁、硫酸钙等会结晶析出。
(1)溶解废渣的溶剂能溶解废渣且不能引进新的杂质,氨水和NaOH不溶解CaO和MgO,稀盐酸能溶解废渣但引进杂质,稀硫酸能溶解废渣且不引进新的杂质,答案选D;(2)为了提高废渣的浸取率,可采用的措施有:将废渣粉碎、加热、搅拌等;(3)A是氧化剂,具有氧化性,能氧化亚铁离子,但不能引进新的杂质且原料易得、成本低,氯气和二氧化锰都具有氧化性,但引进新的杂质且成本高,所以选取空气,氧化过程中发生反应的离子方程式为:4Fe2++O2+4H+═4Fe3++2H2O;(4)分析图象可知在80℃时 溶液PH=1.5,此时亚铁离子的氧化率在90%以上,时间在4h左右;(5)分析可知铵黄铁矾中可能混有的杂质有Fe(OH)3、Ca(OH)2、Mg(OH)2、CaSO4;铵黄铁矾与氨水反应是铁离子与氨水反应生成氢氧化铁和铵盐,反应的离子方程式为Fe3++3NH3H2O=Fe(OH)3↓+3NH4+。

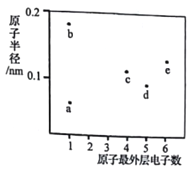
【题目】现有六种元素,其中B、C、D、E为短周期主族元素,F、G为第四周期元素,它们的原子序数依次增大.请根据下列相关信息,回答问题
B元素原子的核外p电子数比s电子数少1 |
C原子的第一至第四电离能分别是:I1=738kJ/mol I2=1451kJ/mol I3=7733kJ/mol I4=10540kJ/mol |
D原子核外所有p轨道全满或半满 |
E元素的主族序数与周期数的相差4 |
F 是前四周期原子电子排布图中单电子数最多的元素 |
G在周期表的第十一列 |
(1)B基态原子的电子排布式为;F基态原子的价电子排布式为;G基态原子的最外层电子排布图为 .
(2)C和与其左右相邻元素原子的第一电离能由大到小的顺序是(用元素符号填空).
(3)B、D的电负性相对大小:BD(用“大于”、“小于”或“等于”填空).
(4)以上六种元素中,位于s区的有种,位于p区的有种.
(5)DE3的电子式为 .